उत्क्रमणीय तथा अनुत्क्रमणीय सेल क्या है उदाहरण दीजिये Reversible and irreversible cell in electrochemistry in hindi
Reversible and irreversible cell in electrochemistry in hindi उत्क्रमणीय तथा अनुत्क्रमणीय सेल क्या है उदाहरण दीजिये ?
वैद्युत-रसायन-II (ELECTRO CHEMISTRY – II)
विषय प्रवेश (Introduction)
एक वैद्युत रासायनिक उपकरण (साधन) जिसके द्वारा वैद्युत ऊर्जा को रासायनिक ऊर्जा में अथवा रासायनिक ऊर्जा को वैद्युत ऊर्जा में परिवर्तित किया जा सके, विद्युत रासायनिक सेल (Electrochemi- cal Cells) अथवा सेल कहलाते हैं। सैल दो प्रकार के होते हैं
(i) वे सेल जिनमें विद्युत ऊर्जा को रासायनिक ऊर्जा में परिवर्तित किया जाता है, अथवा विद्युत ऊर्जा द्वारा रासायनिक क्रिया की जाती है, विद्युत अपघटनी सेल (Electrolytic Cells) कहलाते हैं। उदाहरणार्थ जल का विद्युत विश्लेषण, धातुओं का विद्युत अपघटनी परिष्करण आदि ।
(ii) वे सेल जिनमें रासायनिक ऊर्जा को वैद्युत ऊर्जा में परिवर्तित किया जाता है, अथवा रासायनिक अभिक्रियाओं द्वारा विद्युत ऊर्जा उत्पन्न की जाती है, वैद्युत रासायनिक सेल या गैल्वनी सेल (Galvanic Cells) या वोल्टाइक सेल (Voltaic Cell) कहलाते हैं। उदाहरणार्थ शुष्क सेल (Dry Cells) बैटरी, डेन्यल सैल (Daniell Cell) आदि ।
इस अध्याय में गेल्वनी सेलों का ही विस्तृत रूप में अध्ययन किया जायेगा ।
गैल्वेनी सेल में सामान्यतः धात्विक चालक होते हैं, जिन्हें इलेक्ट्रोड (Electrodes) कहा जाता है। ये इलेक्ट्रोड एक अथवा दो उपयुक्त विद्युत अपघट्यों में डूबे होते हैं। जब इन धात्विक इलेक्ट्रोड़ों को एक धातु के तार द्वारा जोड़ते हैं तो परिपथ में धारा प्रवाहित होने लगती है।
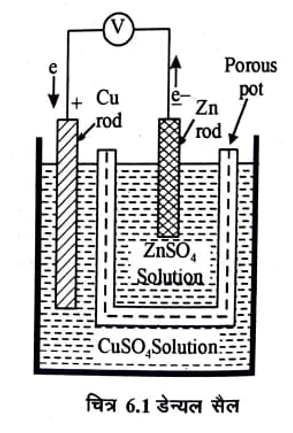
डेन्यल सैल (Daniell’s Cell)
एक सरल गैल्वनी सेल डेन्यल सेल है, इसका उपयोग सामान्यतया प्रयोगशालाओं में किया जाता है। इसमें जिंक तथा कॉपर की छड़ों को इलेक्ट्रोड के रूप में काम में लिया जाता है। ये इलेक्ट्रोड क्रमशः जिंक सल्फेट तथा कॉपर सल्फेट के विलयन में डूबे रहते हैं। इन दोनों को एक संरन्ध्र पात्र (porous pot) की सहायता से पृथक किया जाता है। चित्र 6.1 में डेन्यल सैल दिखाया गया है।
जिंक तथा कॉपर के इलेक्ट्रोडों को एक वोल्टमीटर से जोड़ कर जब एक बाह्य परिपथ बनाया जाता ‘है तो धारा प्रवाहित होने लगती है तथा वोल्टमीटर विक्षेप (deflection) दर्शाता है।
डेन्यल सैल की क्रियाविधि (Mechanism of Daniell’s Cell):
प्रत्येक धातु व हाइड्रोजन का यह गुण होता है कि जब इन्हें जल अथवा इनके आयनों के विलयनों में डुबोया जाता है तो ये इलेक्ट्रॉन त्याग कर धनायन बनाते हैं तथा इनमें साम्य स्थापित हो जाता है। डेन्यल सेल में Zn धातु Zn 2+ तथा Cu धातु Cu2+ के सम्पर्क में रहते हैं अतः इनमें निम्नलिखित साम्य स्थापित हो जाते हैं-‘
धातुओं द्वारा मुक्त इलेक्ट्रॉन इलेक्ट्रोडों पर होते हैं। उपरोक्त धातुओं में Zn की इलेक्ट्रॉन मुक्त करने की प्रवृति Cu की अपेक्षा अधिक होती है, अतः Zn इलेक्ट्रोड पर Cu इलेक्ट्रोड की अपेक्षा अधिक इलेक्ट्रॉन होते हैं। दोनों इलेक्ट्रोडों को बाह्य परिपथ द्वारा जोड़ने पर चित्र में दिखाये अनुसार इलेक्ट्रॉन Zn से Cu की ओर प्रवाहित होने लगते हैं और धारा परिपाटी के अनुसार Cu से Zn की ओर प्रवाहित होने लगती है। धारा प्रवाहित होने पर इलेक्ट्रोड़ों पर होने वाली अभिक्रियाऐं निम्न प्रकार हैं।
इलेक्ट्रोडों पर होने वाली अभिक्रिया इलेक्ट्रोड अभिक्रिया (Electrode Reaction) या अर्द्धसेल अभिक्रिया (Half Cell reaction) कहलाती है। उपरोक्त अभिक्रियाओं से यह स्पष्ट है कि इलेक्ट्रोड़ों पर होने वाली क्रियायें ऑक्सीकरण तथा अपचयन हैं, जबकि सैल अभिक्रिया रेडाक्स (Redox) अभिक्रिया है। अतः गैल्वनी सेल में धारा की उत्पत्ति रेडाक्स अभिक्रिया द्वारा होती है।
इस प्रकार सैल अभिक्रिया द्वारा बाह्य परिपथ में विद्युत धारा प्रवाहित होती रहेगी जब तक कि जिंक की पूरी छड़ घुल न जाए अथवा समस्त कॉपर आयन समाप्त न हो जाए ।
परिपाटी के अनुसार वह इलेक्ट्रोड जिससे इलेक्ट्रोन बाह्य परिपथ में प्रवेश करते हैं अर्थात् जिस इलेक्ट्रोड पर ऑक्सीकरण होता है एनोड़ * (Anode) कहलाता है। डेन्यल सेल में Zn इलेक्ट्रोड एनोड़ की तरह कार्य करता है। वह इलेक्ट्रोड जिसके द्वारा इलेक्ट्रॉन सेल में प्रवेश करते हैं अर्थात् जिस इलेक्ट्रोड पर अपचयन होता है केथोड़ (Cathode) कहलाता है। डेन्यल सेल में Cu इलेक्ट्रोड कैथोड़ की तरह कार्य करता है। जब इलेक्ट्रोड़ों को किसी वोल्टमीटर से जोड़ा जाता है तो वोल्टमीटर इलेक्ट्रोड़ों के विभवान्तर (potential difference) को दर्शाता है। यही विभवान्तर यदि खुले परिपथ में मापा जाये (अर्थात् परिपथ में धारा प्रवाहित न हो रही हो तो इसे विद्युतवाहक बल (Electromotive force) कह हैं। डेन्यल सेल का 298K पर वि.वा.बल 1.088 वोल्ट है।
इलेक्ट्रोड़ों पर विभव उत्पत्ति के सिद्धान्त (Theory of Development of Electrode Potential)
इलेक्ट्रोड़ों पर विभव की उत्पत्ति को समझने के लिए दो सिद्धान्त हैं-
1. नेर्स्ट का विलयन दाब सिद्धान्त (Nernst ‘s Solution Pressure Theory) :- हाइड्रोजन व समस्त धातुओं का यह गुण होता है कि जल के सम्पर्क में आने पर वे इलेक्ट्रॉन कर धनायन बनाते हैं अर्थात् उनकी जल में घुलने की प्रवृति होती है। नर्न्स्ट ने इस प्रवृति को धातुओं का विलयन दाब (Solution Pressure) कहा। तथा कुछ समय पश्चात् निम्नलिखित साम्य स्थापित हो जाता है-
मुक्त हुये इलेक्ट्रॉन धातु पर और धन आवेशित आयन (M+) ऋण आवेशित धातु इलेक्ट्रोड़ों पर एकत्रित हो जाते है। परिणामस्वरूप धातु – विलयन अन्तरापृष्ठ (interface) पर एक वैद्युत – द्विस्तर (electrical doube layer) का निर्माण होता है। इस वैद्युत – द्वि स्तर अथवा आवेश पृथक्करण (charge separation) के कारण विभव उत्पन्न होता है, जिसे इलेक्ट्रोड विभव (electrode potential) कहते हैं।
यदि धातु को उसके आयन के विलयन में डुबोया जाता है तो इलेक्ट्रोड पर उत्पन्न होने वाला आवेश विलयन के परासरण दाब (7) तथा धातु के विलयन दाब (P) के आपेक्षिक मान पर निर्भर करेगा। इस प्रकार से तीन स्थितियाँ सम्भव हैं-
(a) यदि P>: इस स्थिति में धातु इलेक्ट्रोड ऋण आवेशित तथा विलयन धन आवेशित होगा. अतः धातु इलेक्ट्रोड ऋण इलेक्ट्रोड कहलायेगा ।
(b) यदि P< इस स्थिति में धातु इलेक्ट्रोड धन आवेशित व विलयन ऋण आवेशित हो जायेगा, अतः धातु इलेक्ट्रोड धन इलेक्ट्रोड कहलायेगा ।
(c) यदि P= : इस स्थिति में धातु एवं विलयन पर कोई आवेश नहीं होगा, अर्थात् इलेक्ट्रोड तथा विलयन के अन्तरापृष्ठ पर कोई विभव उत्पन्न नहीं होगा, अतः इलेक्ट्रोड शून्य इलेक्ट्रोड (null electrode) कहलायेगा ।
2. आधुनिक सिद्धान्त (Modern Theroy) :-
आधुनिक परिप्रेक्ष्य में विलयन दाब का सिद्धान्त लगभग लुप्त हो गया है। आधुनिक सिद्धान्त में धातु-विलयन अन्तरापृष्ठ पर वैद्युत द्विस्तर का निर्माण दो विपरीत प्रक्रमों की आपेक्षित गति का परिणाम माना जाता है। धातु का आयन के रूप में विलयन में जाना एक प्रक्रम है तथा विलयन में से धातु आयनों का इलेक्ट्रोड पर निक्षेपित होना दूसरा प्रक्रम है। यदि धातु आयनों का विलयन में जाने का वेग अधिक और धातु आयनों के निरपेक्ष होने का वेग कम है तो धातु ऋण इलेक्ट्रोड होगा, और यदि विपरीत स्थिति हो तो धातु धन इलेक्ट्रोड होगा। इन दोनों ही स्थितियों में इलेक्ट्रोडों पर विभव उत्पन्न होगा । यदि दोनों प्रक्रमों के वेग समान हों तो शून्य इलेक्ट्रोड बनेगा ।
संकेत पद्धतियां तथा चिन्ह परिपाटियाँ (Nations and Sign Conventions)
सुविधा की दृष्टि ये सेल को चित्र की अपेक्षा आरेख द्वारा प्रदर्शित किया जाता है। सेल आरेख बनाने के लिए कुछ संकेतों (Notations) तथा चिन्ह परिपाटियों (Sign Conventions) की सहायता ली जाती है। जिन्हें संक्षेप में निम्न बिन्दुओं में संकलित किया गया है-
(i) अन्तरापृष्ठ, जहाँ विभवान्तर विद्यमान रहता है को एक खड़ी रेखा खींच कर प्रदर्शित करते हैं। जैसे डेनियल सेल में जिंक इलेक्ट्रोड ZnSO4 (Zn 21 ) के सम्पर्क में व कॉपर इलेक्ट्रोड Cu2 + (CuSO4) के सम्पर्क में। अर्थात् Zn | Zn 2+ तथा Cu | Cu2 + |
(ii) यदि धातु तथा धातु आयन, अधातु तथा अधातु आयन भिन्न-भिन्न सान्द्रता के विलयन अथवा भिन्न–भिन्न विद्युत अपघट्यों के विलयन सीधे एक दूसरे के सम्पर्क में होते हैं तो उनके सूत्रों अथवा प्रतीकों के मध्य एक खड़ी रेखा खींचकर दर्शाया जाता है, उदाहरणार्थ-
यदि आवश्यक हो तो पदार्थों की भौतिक अवस्था भी साथ दर्शायी गयी है, जैसे-
(ii) यदि विद्युत अपघट्यों की विभिन्न सान्द्रता के विलयन अथवा विभिन्न विद्युत अपघट्यों के विलयन एक दूसरे के सीधे सम्पर्क में नही हो बल्कि लवण सेतु (Salt Bridge) अथवा सरंध्र पात्र (Porous Pot) के माध्यम से सम्पर्क में हो तो उनके बीच दो खड़ी रेखायें खींची जाती हैं। जैसे-
सम्पूर्ण सैल को प्रदर्शित करने में ऐनोड़ को (जिससे इलेक्ट्रॉन बाह्य परिपथ मे प्रवेश करते हैं) बायीं और तथा कैथोड़ को (जिससे इलेक्ट्रॉन सेल में प्रवेश करते हैं) दाहिनी और इस प्रकार लिखा जाता है कि धातु हमेशा बाहर के छोर पर रहें। डेन्यल सेल को निम्न प्रकार लिखते हैं-
(v) यह दर्शाने के लिए कि बायीं ओर का इलेक्ट्रोड ऋणात्मक और दाहिनी ओर का इलेक्ट्रोड धनात्मक होता है, ऋणात्मक तथा धनात्मक चिन्हों को कभी-कभी क्रमशः ऐनोड तथा कैथोड के ऊपर भी लिखा जा सकता है। जैसे
(vi) सेलों का विद्युत वाहक बल चूंकि ताप, अपघट्य की सान्द्रताओं (सक्रियता), गैसों के दाब पर भी निर्भर करता है अतः सम्पूर्ण सेल का आरेख लिखने में इनका उल्लेख भी आवश्यक हैं। जैसे-
उत्क्रमणीय तथा अनुत्क्रमणीय सेल (Reversible and Irreversible Cells)
गल्वनी सेल निम्न में से कोई विशिष्ट लक्षण प्रदर्शित करते हैं-
(a) इलेक्ट्रोड़ों पर अभिक्रिया तब ही होती है जबकि सेल से विद्युत धारा प्राप्त की जाती है, अर्थात् इलेक्ट्रोडों को बाह्य परिपथ में तार द्वारा जोड़ा जाता है।
(b) इलेक्ट्रोड़ों पर अभिक्रिया तब भी होती रहती है जबकि सेल से विद्युतधारा प्राप्त नहीं की जाती है। अर्थात् इलेक्ट्रोडों को बाह्य परिपथ में नहीं जोड़ा जाता है।
वे सेल जो लक्षण (a) प्रदर्शित करते हैं, उत्क्रमणीय सेल ( reversible cell) कहलाते हैं तथा वे सेल जो लक्षण (b) प्रदर्शित करते हैं, अनुत्क्रमणीय सेल (irreversible cell) कहलाते हैं। ऊष्मागतिकी के अनुसार वे अभिक्रियायें उत्क्रमणीय होती हैं, जिनमें-
(i) प्रेरक बल (driving force) तथा विरोधी बल (opposing force) में अन्तर सूक्ष्म (infinitely small) हो जाये।
(ii) यदि विरोधी बल प्रेरक बल की अपेक्षा अनन्त सूक्ष्म अधिक कर दिया जाये तो प्रक्रम उत्क्रमित (reverse) हो जाये।
एक सेल के सन्दर्भ में इन शर्तों के अनुसार (i) सेल के वि.वा.बल से अनन्त सूक्ष्म कम वि.वा. बल का एक बाह्य स्त्रोत विपरीत दिशा में जोड़ दिया जाये तो सेल से अनन्त सूक्ष्म मात्रा में धारा प्राप्त की जा सके। (ii) यदि विपरीत दिशा में लगाया गया वि.वा.बल सेल के वि.वा.ब के समान हो तो कोई विद्युत प्रवाहित न हो। (iii) यदि विरोधी वि.वा.बल ओर बढ़ा दिया जाये जो धारा विपरीत दिशा में प्रवाहित हो और सेल अभिक्रिया उत्क्रमित हो जाये। इन शर्तों का पालन करने वाला सेल उत्क्रमणीय सेल कहलाता है। यदि सेल उपरोक्त शर्तों का पालन नहीं करता तो वह अनुत्क्रमणीय सेल कहलाता है। डेन्यल सेल एक उत्क्रमणीय सेल है। इस सेल को विपरीत दिशा में कार्य करने वाले श्रोत से जोड़ देते है। जिसका वि.वा.ब सेल के वि.वा.बल से अनन्त सूक्ष्म कम हो तो सेल में अनन्त सूक्ष्म धारा प्राप्त की जा सकती है। इस स्थिति में सेल अभिक्रिया निम्न प्रकार होगी-
यदि बाह्य स्त्रोत का वि.वा.बल सेल के वि.वा.बल के समान हो जाता है तो कोई धारा प्रवाहित नही होती है और सेल अभिक्रिया निम्न प्रकार साम्य अवस्था में होती है-
यदि बाह्य स्त्रोत का वि.वा.बल सैल के वि.वा.बल से अनन्त सूक्ष्म अधिक कर दिया जाये तो धारा विपरीत दिशा में प्रवाहित होने लगती है। और सेल अभिक्रिया निम्नानुसार होने लगती है-
यह अभिक्रिया पूर्व अभिक्रिया की विपरीत है, और धारा भी विपरीत दिशा में प्राप्त होती है, अतः डेन्यल सेल एक उत्क्रमणीय (reversible) सेल है।
एक निम्न सेल पर विचार कीजिये-
Zn तथा Cu इलेक्ट्रोडों को तार द्वारा जोड़ने पर इलेक्ट्रॉन Zn से Cu की ओर प्रवाहित होंगे और निम्न इलेक्ट्रोड एवं सेल अभिक्रियाऐं होगी-
अतः H2 गैस Zn इलेक्ट्रोड पर निकलेगी।
इस सेल में यदि बाह्य श्रोत से वि. वा. बल विपरीत दिशा में लगाया जाता है तो धारा की दिशा तो परिवर्तित हो जाती है परन्तु इलेक्ट्रोड और सेल अभिक्रियायें निम्न प्रकार होती है
यह अभिक्रिया पूर्व अभिक्रिया की विपरीत नहीं है। चूंकि यह सेल उत्क्रमणीयता की शर्तों का पालन नहीं करता है अतः यह अनुत्क्रमणीय सेल (ireversible cell) का उदाहरण है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics