picric acid in hindi Physical Chemical Properties पिक्रिक अम्ल क्या है संरचना बनाने की अभिक्रिया
पिक्रिक अम्ल क्या है संरचना बनाने की अभिक्रिया picric acid in hindi Physical Chemical Properties ?
पिक्रिक अम्ल (Picric acid) – 2, 4, 6- ट्राइ नाइट्रोफीनोल
o- तथा p-नाइट्रोफीनोल का नाइट्रीकरण करने पर पहले 2,4-डाइनाइट्रो फीनोल तथा बाद में 2,4,6- ट्राइनाइट्रो फीनोल प्राप्त होता है। इस विधि से पिक्रिक अम्ल की लब्धि कम प्राप्त होती हैं। नाइट्रीकरण में सान्द्र HNO3 काम में लिया जाता है, यह एक प्रबल ऑक्सीकारक है अतः फीनोल का ऑक्सीकरण
कर देता है 1
पिक्रिक अम्ल की अधिक मात्रा निम्नलिखित विधियों से प्राप्त की जा सकती है।
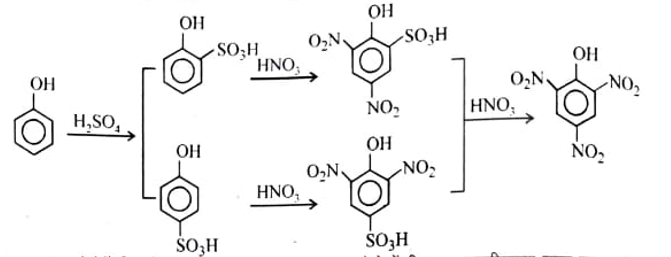
(1) फीनोल से (From Phenol) – फीनोल का सल्फोनीकरण करने के बाद नाइट्रीकरण करने से पिक्रिक अम्ल प्राप्त होता है। फीनोल के सल्फोनीकरण से – SO3H समूह उपस्थापित हो जाता है। यह इलेक्ट्रॉन को अपनी ओर आकर्षित करने वाला समूह है। अतः इस यौगिक का HNO3 अम्ल से ऑक्सीकरण नहीं होता है।
(2) क्लोरोबेंजीन से (From chlorobenzene ) – क्लोरो बेंजीन का नाइट्रीकरण उच्च ताप व दाब पर किया जाता है जिससे 2,4- डाइनाइट्रो क्लोरोबेंजीन प्राप्त होता है। इस प्राप्त यौगिक को सोडियम कार्बोनेट के जलीय विलयन से अभिक्रिया करवाते हैं। उसके बाद नाइट्रीकरण से पिक्रिक अम्ल प्राप्त करते है।
1,3,5 – ट्राइनाइट्रो बेंजीन का पोटैशियम फेरीसाइनाइड द्वारा ऑक्सीकरण करने से पिक्रिक अम्ल प्राप्त होता है। इस विधि से प्रयोगशाला में पिक्रिक अम्ल प्राप्त कर सकते हैं।
भौतिक गुण (Physical Properties) –
पिक्रिक अम्ल एक पीले रंग का क्रिस्टलीय, कड़वे स्वाद वाला ठोस पदार्थ है। इसका द्रवणांक 122° है। यह ठंडे पानी में कम घुलनशील किन्तु गरम पानी, ईथर तथा ऐल्कोहॉल में अधिक घुलनशील है।
रासायनिक गुण (Chemical Properties)
(i) हाइड्रॉक्सी समूह की o तथा p- स्थितियों पर – NO2 समूह उपस्थित होने के कारण यह एक प्रबल अम्ल है। अतः यह सोडियम कार्बोनेट एवं बाईकार्बोनेट के साथ झाग (effervescence) देता है।
(iii) पिक्रिक अम्ल का विरंजक चूर्ण (Bleaching powder) के जलीय विलयन के साथ आसवन किया जाये तो क्लोरोपिक्रिन (Nitro chloroform CCI3NO2 ) प्राप्त होता है। प्रथम विश्व युद्ध में इस यौगिक को एक रासायनिक हथियार के रूप में काम में लिया गया था।
(iv) पिक्रिक अम्ल का सोडियम सल्फाइड से अपचयन करने पर पिक्रेमिक अम्ल बनता है।
(5) आवेश स्थानान्तरण संकुल का बनाना – पिक्रिक अम्ल, ऐरोमैटिक हाइड्रोकार्बन, फीनोल एवं . ऐमीन के साथ लाल पीले रंग के पिक्रेट बनाता है। ये पिक्रेट आवेश स्थानान्तरण संकुल कहलाते हैं । इसके विषय में B.Sc. Pt. I में विस्तार से दिया जा चुका है। ये पिक्रेट कार्बनिक यौगिकों की पहचान के लिये प्रयुक्त होते हैं। उदाहरणार्थ- ऐन्थ्रेसीन पिक्रिक अम्ल के साथ लाल पीले रंग का क्रिस्टलीय पिक्रेट बनाता हैं। इसमें पिक्रिक अम्ल एक इलेक्ट्रॉन ग्राही ( लूइस अम्ल) और ऐन्थ्रेसीन इलेक्ट्रॉन दाता (लूइस क्षार) की भाँति कार्य करते हैं।
पिक्रिक अम्ल को रेशम एवं ऊन को रंगने के लिये रंजक के रूप में काम में लिया जा सकता है। यह एक प्रबल विस्फोटक के रूप में भी काम में लिया जाता है। पिक्रिक अम्ल का 1% विलयन कुछ चर्म रोगों के उपचार में तथा शरीर के किसी जले हुए भाग के दर्द को कम करने के लिये काम में लिया जाता है।
हैलोनाइट्रोऐनीन (Halonitroarenes)
वे ऐरोमैटिक यौगिक जिनमें हैलोजन एवं नाइट्रो समूह बेंजीन वलय में उपस्थित होते हैं, हैलोनाइट्रोऐरीन कहलाते हैं।
उदाहरणार्थ-
बनाने की विधियाँ- o- एवं p- हैलोनाइट्रोबेंजीन को हैलोबेंजीन के नाइट्रीकरण से बनाते हैं।
उदाहरणार्थ-
m- हैलोनाइट्रोबेंजीन को नाइट्रोबेंजीन के क्लोरीनीकरण से बना सकते हैं-
रासायनिक क्रियाशीलता (Chemical Reactivity)
– हैलोनाइट्रोऐरीन नाभिकस्नेही प्रतिस्थापन अभिक्रियाऐं सुगमता से दे देते हैं। इनमें हैलोनाइट्रोऐरीन का हैलोजन परमाणु नाभिक स्नेही जैसे : OH NH2 एवं : OR द्वारा आसानी से प्रतिस्थापित हो जाता है। हैलोबेंजीन में बेंजीन के sp – संकरित C- परमाणु और हैलोजन परमाणु के मध्य C-X बंध में हैलोजन के एकाकी इलेक्ट्रॉन युग्म का बेंजीन वलय पर अस्थानीकरण हो जाने के कारण द्विबंध गुण आ जाता है। अतः यह माना जाता है कि हैलोबेंजीन में हैलोजन परमाणु नाभिक स्नेही अभिकर्मकों के प्रति अक्रियाशील है। यदि हैलोबेंजीन में हैलोजन परमाणु के ऑर्थो या पैरा या ऑर्थो एवं पैरा स्थितियों पर इलेक्ट्रॉन आकर्षी समूह जैसे – NO2, नाइट्रोसो, – COOH, SO3H, CHO, COR आदि उपस्थित हों तो हैलोबेंजीन की क्रियाशीलता नाभिक स्नेही प्रतिस्थापन के लिये बढ़ जाती है। उदाहरणार्थ- क्लोरोबेंजीन NaHCO3 के जलीय विलयन के साथ कोई अभिक्रिया नहीं करता है परन्तु ऑर्थो-क्लोरो नाइट्रोबेंजीन जलीय NaHCO3 के साथ 130°C पर नाभिक स्नेही प्रतिस्थापन द्वारा ऑर्थो नाइट्रोफीनॉल बनाता है। यदि प्रबल इलेक्ट्रॉन आकर्षी – NO2 समूह CI परमाणु के o- एवं p- दोनों स्थितियों पर उपस्थित हों तो CI परमाणु का –OH समूह द्वारा प्रतिस्थापन 100°C पर ही हो जाता है। इसी प्रकार यदि CI परमाणु की दोनों o-स्थितियों एवं p-स्थिति पर नाइट्रो समूह उपस्थित हों तो CI परमाणु का – OH समूह के द्वारा प्रतिस्थापन 35°C पर ही हो जाता है।
नाभिकस्नेही प्रतिस्थापन की क्रियाविधि हैलोनाइट्रोऐरीन में हैलोजन समूह का नाभिक स्नेही प्रतिस्थापन निम्नलिखित क्रिया-विधियों द्वारा होता है-
योगात्मक-विलोपन क्रिया-विधि (Addition- Elimination mechanism ) – जैसा कि ऊपर बताया गया है बेंजीन वलय पर हैलोजन परमाणु की ऑर्थो या पैरा स्थितियों पर प्रबल इलेक्ट्रॉन आकर्षी समूह उपस्थित होने पर ऐरिल हैलाइड नाभिक स्नेही प्रतिस्थापन के लिये सुग्राही हो जाते हैं। इस प्रकार के ऐरिल हैलाइड व्युत्पन्नों में नाभिक स्नेही प्रतिस्थापन योगात्मक – विलोपन क्रियाविधि के द्वारा होता है। क्रिया – विधि को p- नाइट्रोक्लोरो बेंजीन की जलीय सोडियम बाइकार्बोनेट के साथ 130° से. पर अभिक्रिया द्वारा सुगमता से समझा जा सकता है।
प्रथम पद में आक्रमणकारी नाभिक स्नही (OH)p – नाइट्रोक्लोरो बेंजीन के क्लोरीन परमाणु वाले C- परमाणु पर योग करके एक अस्थानीकृत कार्बऐनियन बनाता है। यह कार्बऐनियन अनुनाद के द्वारा स्थायी हो जाता है।
दूसरे पद में अस्थानीकृत कार्बऐनियन से हैलोजन आयन (अवशिष्ट समूह) का विलोपन हो जाता है और वलय की ऐरामैटिकता पुनः स्थापित हो जाती है।
o – नाइट्रोक्लोरोबेंजीन में नाभिक स्नेही प्रतिस्थापन निम्न प्रकार प्रदर्शित कर सकते हैं-
हैलोबेंजीन के m—स्थिति पर इलेक्ट्रॉन आकर्षी समूह (NO2 ) उपस्थित होने पर इसकी अभिक्रियाशीलता पर कोई प्रभाव नहीं पड़ता।
ऐमीन्स (Amines )
ऐमीन का वर्गीकरण एवं नामकरण (Nomenclature and Classification of Amine)
ऐमीन अमोनिया के व्युत्पन्न होते हैं जिनमें अमोनिया के एक या अधिक हाइड्रोजन परमाणुओं का विस्थापन ऐल्किल (R) या ऐरिल (Ar ) समूहों द्वारा किया जाता है। अमोनिया से एक, दो और तीन हाइड्रोजन परमाणुओं के ऐल्किल या ऐरिल समूहों द्वारा विस्थापन पर क्रमशः प्राथमिक, द्वितीयक और तृतीयक ऐमीन प्राप्त होते हैं।
इस प्रकार प्राप्त प्राथमिक, द्वितीयक और तृतीयक ऐमीन में क्रमशः ऐमीनों समूह (-NH2). इमीनो समूह (>NH) और तृतीयक नाइट्रोजन – N उपस्थित होते हैं। द्वितीयक और तृतीयक ऐमीन में नाइट्रोजन परमाणु पर समान या असमान ऐल्किल या ऐरिल समूह उपस्थित हो सकते हैं। जब सभी समान समूह उपस्थित हों तो इन्हें सरल अथवा सममित और भिन्न समूह उपस्थित हों तो मिश्रित अथवा असममित ऐमीन कहते हैं।
ऐरोमैटिक ऐमीन दो प्रकार के होते हैं-
(i) ऐमीनों समूह सीधे बेंजीन वलय से जुड़ा हो जैसे-
(ii) ऐमीनों समूह पार्श्व श्रृंखला में उपस्थित हो। जैसे—
नामकरण की साधारण या रूढ पद्धति में ऐमीन को ऐल्किल या ऐरिल ऐमीन नाम दिया गया है। नाइट्रोजन पर लगे ऐल्किल या ऐरिल समूह का नाम लिख कर इनके साथ संलग्न ‘ऐमीन’ लगाकर इनका नाम सरलता से लिखा जा सकता है, जैसे-
द्वितीयक एवं तृतीयक ऐमीन में उपस्थित ऐल्किल या ऐरिल समूहों को अंग्रेजी वर्णमाला के क्रम में लिखने के बाद “ऐमीन” शब्द लिखा जाता है। यदि एक ही प्रकार के समूह उपस्थित हों तो उस समूह के नाम से पहले डाइ या ट्राइ लिखकर उनकी संख्या प्रदर्शित की जाती है।
ऐरोमेटिक ऐमीन दो प्रकार के संभव है-
(i) जहां ऐमीनो समूह सीधे बेंजीन वलय से जुड़ा है, जैसे-
(ii) जहाँ ऐमीनो समूह सीधे बेंजीन वलय से न जुड़ा होकर किसी पार्श्व श्रृंखला में हो जैसे-
दूसरे प्रकार के यौगिक रासायनिक गुणों में ऐलिफैटिक यौगिकों से मेल खाते हैं इस कारण सामान्यतः पहले प्रकार के यौगिकों को ही ऐरोमैटिक ऐमीन कहा जाता है। चूंकि इस प्रकार का साधारण ऐमीन ऐनिलीन है अतः ऐरोमैटिक ऐमीनों को ऐनिलीन का व्युत्पन्न मान कर नामकरण किया जाता है।
यदि बेंजीन वलय में NH, समूह के अतिरिक्त – CH, समूह और जुड़ा हुआ हो तो इसे टॉलूडी कहा जाता है। जैसे-
नामकरण की IUPAC पद्धति में दीर्घतम कार्बन श्रृंखला या वलय के नाम के अन्त में अनुलग्न ऐमीन जोड़कर नामकरण किया जाता है। जैसे-
द्वितीयक या तृतीयक ऐमीन मे दीर्घतम श्रृंखला युक्त समूह को आधार मानकर अन्य प्रतिस्थापियों के नाम अंग्रेजी वर्णमाला क्रम में रखकर नामकरण किया जाता है। जैसे-
यह ध्यान देने योग्य है कि व्यावहारिक दृष्टि से नामकरण की रूढ़ पद्धति द्वारा दिये गये नामों को स्वीकार कर लिया जाता है।
संरचना एवं बंधन (Structure and Bonding )
ऐलिफैटिक ऐमीन की संरचना: ऐलिफैटिक ऐमीन्स की बंध संरचना NH, के समान ही है क्योकि ये अमोनिया के ऐल्किल व्युत्पन्न है । ऐमीन में भी N- परमाणु की sp3 संकरित अवस्था होती है।
इस प्रकार चार sp3 संकरित कक्षकों में से एक में एकाकी इलेक्ट्रॉन युग्म होता है और अन्य तीन, H परमाणु के s- कक्षक या ऐल्किल समूह के C-परमाणु के sp संकरित कक्षक से ठ बंध बना लेते हैं अमोनिया, प्राथमिक, द्वितीयक एवं तृतीयक ऐमीन की संरचना एवं उनमें बंधन निम्न प्रकार प्रदर्शित कर सकते हैं-
N-परमाणु पर एकाकी इलेक्ट्रॉन युग्म होने के कारण इनमें बंध कोण 109°28′ से कम होते हैं। चूंकि
1. p b. p प्रतिकर्षण > bp bp. प्रतिकर्षण ।
नाइट्रोजन परमाणु पर एकाकी इलेक्ट्रॉन युग्म होने के कारण अमोनिया एवं ऐमीन्स की त्रिकोणीय पिरैमिडी आकृति होती है जिसमें H / ऐल्किल समूह आधारीय त्रिकोण के कोनों पर और N – परमाणु पिरैमिड के शीर्ष पर उपस्थित होता है ।
थल ऐमीन में C-NH बंध कोण लगभग 107° का होता है जबकि द्वितीयक एवं तृतीयक ऐमीन में यह बंध कोण ऐल्किल समूहों के अन्तआण्विक प्रतिकर्षण के कारण बढ़ जाता है।
ऐरोमैटिक ऐमीन की संरचना-
ऐरामैटिक ऐमीन उदाहरणार्थ- ऐनिलीन में NH2 समूह के N – परमाणु को sp2 – संकरित भी माना जा सकता है-
अतः N-परमाणु बेंजीन वलय के C – परमाणु के साथ sp2 – sp 2 o बंध बनाता है और दो H- परमाणुओं के साथ sp——s अतिव्यापन द्वारा दो N-H (6) बंध बनाता है इस प्रकार N के एक शुद्ध p- कक्षक में एकाकी इलेक्ट्रॉन युग्म रहता है। नाइट्रोजन के शुद्ध p-कक्षक में एकाकी इलेक्ट्रॉन युग्म होने पर यह बेंजीन वलय के ग़-कक्षकों के साथ सुगमता से अतिव्यापन करके अस्थानीकृत – आणविक कक्षक बना लेता है जो बेंजीन वलय के छः कार्बन परमाणुओं और NH2 समूह के N – परमाणु पर विस्तारित होता है। परन्तु N— परमाणु की विद्युतॠणता C- परमाणु से अधिक है। इसकी इलेक्ट्रॉन आकर्षी प्रवृत्ति भी होती है। इसके द्वारा इलेक्ट्रॉन उस दशा में अधिक प्रभावी रूप से आकर्षित होंगे जब इसके संकरण में s – गुण अधिक हों अर्थात् N – परमाणु भी sp संकरित अवस्था हो। अतः यह कहा जा सकता है कि ऐरोमैटिक ऐमीन में – NH2 समूह के N – परमाणु की संकरित अवस्था sp2 एवं sp3 के बीच होती
है ।
ऐनिलीन के विभिन्न अनुनादी इलेक्ट्रॉनीय संरचनाओं को निम्न प्रकार प्रदर्शित कर सकते हैं-
ऐमीनो समूह के N – परमाणु के एकाकी युग्म इलेक्ट्रॉनों का अस्थानीकरण हो जाने के कारण N- परमाणु पर इलेक्ट्रॉन घनत्व कम हो जाता है इसलिये ऐरोमैटिक ऐमीन की क्षारीय प्रकृति कम हो जाती है। बेंजीन वलय पर इलेक्ट्रॉन घनत्व बढ़ जाने के कारण वलय इलेक्ट्रॉन स्नेही आक्रमण की सुगमता बढ़ जाती है।
ऐल्किल एवं ऐरिलऐमीन बनाने की विधियाँ
1 हॉफमान अमोनी अपघटन (Hofmann’s ammonolysis)
अमोनिया या ऐल्किल ऐमीन के जलीय या ऐल्कोहॉलिक विलयन को ऐल्किल हैलाइड के साथ एक बंद नलिका में गर्म करने पर अमोनियम लवण प्राप्त होते हैं। इन अमोनियम लवणों को प्रबल क्षार के साथ गर्म करने पर ऐमीन मुक्त हो जाते हैं। अमोनिया लेने पर प्राथमिक ऐमीन बनता है ।
प्राथमिक ऐमीन लेने पर द्वितीयक ऐमीन बनता है। –
द्वितीयक ऐमीन लेने पर तृतीयक ऐमीन बनता है।
उपर्युक्त अभिक्रियाएं मोनो ऐल्किलीकरण पर ही नहीं रूक जाती अपितु आगे भी सम्पन्न होती हैं। क्योंकि उपर्युक्त किसी भी अभिक्रिया में बना ऐमीन नाभिकस्नेही के रूप में ऐल्किल हैलाइड से आगे भी अभिक्रिया कर लेता है।
तृतीयक ऐमीन ऐल्किल हैलाइड से अभिक्रिया करके चतुष्क अमोनियम लवण बनाता है।
अमोनिया या ऐमीन की अधिकता लेने पर आगे ऐल्किलीकरण को कम किया जा सकता है। इस विधि से ऐरोमैटिक ऐमीन सुगमता से नहीं बनाये जा सकते क्योंकि बेंजीन वलय से जुड़ा हैलोजन परमाणु नाभिक स्नेही प्रतिस्थापन के प्रति बहुत कम क्रियाशील होता है।
ऐल्किल हैलाइड से प्राथमिक ऐमीन बनाने के लिए पहले ऐल्किल हैलाइड की सोडियम ऐजाइड से अभिक्रिया करके उसे ऐल्किल ऐजाइड में बदल लेते हैं। ऐल्किल ऐजाइड का LiAlH या Na/ ऐथेनॉल से अपचयन करने पर प्राथमिक ऐमीन बनते हैं।
नाइट्रो यौगिकों के अपचयन से (Reduction of nitro compounds)-
नाइट्रो यौगिकों के अपचयन से ऐलिफैटिक एवं ऐरोमैटिक दोनों प्रकार के प्राथमिक ऐमीन बनाये जा सकते है परन्तु मुख्यतः यह विधि ऐरोमैटिक ऐमीन बनाने में प्रयुक्त होती है।
(1) नाइट्रोऐल्केन लीथियम ऐलुमिनियम हाइड्राइड या धातु – अम्ल अपचयित या उत्प्रेरित हाइड्रोजनीकरण (H2/Ni) द्वारा संगत ऐल्केनऐमीन में बदल जाते है।
(2) ऐरोमैटिक नाइट्रोयौगिक Sn / HCI या Fe / HCI द्वारा अपचयन या Ni, Pd, या Pt की उपस्थिति में उत्प्रेरित हाइड्रोजनीकरण द्वारा ऐरोमैटिक ऐमीन में बदल जाते है।
एक डाइनाइट्रो यौगिक में एक नाइट्रो समूह का अपचयन अमोनियम हाइड्रोजन सल्फाइड NH SH या ऐल्कॉहॉली जलीय अमोनियम में HS2 के द्वारा करते हैं।
नाइट्राइलों के अपचयन से ( By reduction of nitriles)
नाइट्राइलों (R-C=N) के अपचयन से प्राथमिक ऐमीन प्राप्त होते हैं। अपचयन LiAiH4 या उत्प्रेरक (Ni, Pd, Pt) की उपस्थिति में H2 या Na/ एथेनॉल से करते हैं।
नाइट्राइलों का Na/C2H5OH से अपचयन मेण्डिअस अभिक्रिया (Mendius Reaction) कहलाती
ऐल्डिहाइड एवं कीटोन के अपचयित ऐमीनीकरण से- (Reductive amination of aldehydes and ketons)
ऐल्डिहाइड एवं कीटोन का अमोनिया या ऐमीन की उपस्थिति में उत्प्रेरित या रासायनिक अपचयन करने पर प्राथमिक, द्वितीयक एवं तृतीयक ऐमीन बनाये जा सकते हैं।
इस प्रक्रिया को ऐल्डिहाइड एवं कीटोन की अपचयित ऐमीनीकरण या ऐमीन का अपचयित ऐल्किलीकरण कहते है। अभिक्रिया की क्रिया विधि निम्न प्राथमिक ऐमीन बनाने के लिए निम्न प्रकार दी जा सकती है।
गैब्रिल थैलिमाइड अभिक्रिया (Garbriel – Phthalimide Reaction)
थैलिक अम्ल को गर्म करने पर प्राप्त ऐनहाइड्राइड अमोनिया से क्रिया कर थैलिमाइड बनाता है। यह KOH से क्रिया करके पोटैशियम थैलिमाइड बनाता है जो ऐल्किल हैलाइड से अभिकृत होकर N- ऐल्किल थैलिमाइड देता है जिसके जल अपघटन से प्राथमिक ऐमीन प्राप्त होते हैं।
यह अभिक्रिया अमोनिया का अप्रत्यक्ष रूप से ऐल्किलीकरण ही है। ऐल्किल हैलाइड में जितने C- परमाणु होते हैं उतने ही प्राप्त प्राथमिक ऐमीन में होते हैं।
हॉफमान ब्रोमेमाइड अभिक्रिया (Hoffmann bromamide reaction)
ऐसे ऐमाइड जिनमें N-परमाणु पर कोई प्रतिस्थापी नहीं होता ब्रोमीन या क्लोरीन के सोडियम हाइड्रॉक्साइड या पोटैशियम हाइड्रॉक्साइड विलयन के साथ अभिक्रिया करके एक कार्बन कम युक्त ऐमीन बनाते हैं। इस अभिक्रिया को हॉफमान पुनर्विन्यास या हॉफमान निम्नीकरण (Hoffmann degradation) कहते हैं।
अभिक्रिया की क्रिया विधि के लिए अध्याय -7 में ऐमाइड की अभिक्रियाएं खण्ड 7.7.4 देखें ।
उदाहरण-
कर्टियस अभिक्रिया :-
जब ऐसिड को गरम करते हैं तो पुनर्विन्यास द्वारा आइसोसायनेट बनता है जो जल अपघटन पर प्राथमिक ऐमीन देता है। इस अभिक्रिया में भी हाफमैन ब्रोमेमाइड अभिक्रिया के समान ही पुनर्विन्यास होता है ।
सोडियम ऐजाइड का निर्माण ऐसिड हैलाइड की सोडियमऐजाइड की अभिक्रिया द्वारा होता है।
श्मिट अभिक्रिया (Schmidt’s reaction) :- यह कर्टियस अभिक्रिया के समान है। इसमें हाइड्रेजोइक अम्ल की अभिक्रिया H2SO4 की उपस्थिति मे ऐसीटिक अम्ल से कराते हैं।
हाइड्रेजोइक अम्ल विषैली तथा विस्फोटक प्रकृति का होता है अतः यह अभिक्रिया सावधानी पूर्वक संचालित की जाती है।
लॉसेन पुनर्विन्यास (Lossen’s rearrangement ) :- जब हाइड्रॉक्सिामिक अम्लों को प्रबल अकार्बनिक अम्लों के साथ गरम किया जाता है तो हॉफमैन अभिक्रिया के समान पुनर्विन्यास पर प्राथमिक ऐमीन का निर्माण होता है।
भौतिक गुण (Physical properties)
(i) इस श्रेणी के निम्नतर सदस्य साधारण ताप पर रंगहीन गैस होते हैं, जबकि उच्चतर सदस्य रंगहीन वाष्पशील द्रव होते हैं तथा बहुत उच्च अणुभार वाले सदस्य ठोस अवस्था में पाये जाते हैं।
(ii) निम्न अणुभार वाले ऐमीन में अमोनिया जैसी प्रबल गंध आती है। अणुभार बढ़ने के साथ गंध भी कम होती जाती हैं। साधारणतया ऐलीफैटिक ऐमीन में मछली के समान गंध आती है
(iii) क्वथनांक- प्राथमिक एवं द्वितीयक ऐमीन में अन्तराअणुक हाइड्रोजन बंधन के कारण आण्विक संगणन हो जाता है। इसलिये इनका क्वथनांक तुलनात्मक अणुभार वाले ऐल्केनों की अपेक्षा उच्च होता है।
ऐल्कोहॉल में O-H बंध ऐमीन के NH बंध की अपेक्षा अधिक ध्रुवीय होता है क्योंकि ऑक्सीजन की विद्युतऋणता N परमाणु से अधिक है अतः ऐल्कोहॉलों में अन्तराअणुक हाइड्रोजन बंध अपेक्षाकृत प्रबल बनते हैं। इसलिये ही ऐमीनों का क्वथनांक तुलनात्मक अणुभार वाले ऐल्कोहॉलों की अपेक्षा कम होता है ।
प्राथमिक ऐमीन का क्वथनांक द्वितीयक से अधिक और द्वितीयक का तृतीयक ऐमीन से अधिक है इसका कारण प्राथमिक ऐमीन में हाइड्रोजन बंधन के लिये दो N-H बंधों की उपलब्धता द्वितीयक ऐमीन में एक NH बंध की उपलब्धता है जबकि तृतीयक ऐमीन में H – बंधन नहीं होता है।
ऐरोमैटिक ऐमीन का क्वथनांक ऐलिफैटिक ऐमीन से अपेक्षाकृत अधिक होता है।
(iv) विलेयता C से C तक के प्राथमिक, द्वितीयक एवं तृतीयक ऐमीन जल में विलेय होते हैं लेकिन ऐस्किल समूह का आकार (हाइड्रोकार्बन भाग) बढ़ने पर विलेयता घटती है क्योंकि हाइड्रोकार्बन भाग जल प्रतिकर्षी होता है। जल में इनकी विलेयता जल के साथ अन्तराअणुक हाइड्रोजन बंध बनाने के कारण होती है।