physical properties of phenols class 12 in hindi फिनोल का सामान्य भौतिक गुण क्या है कक्षा 12
फिनोल का सामान्य भौतिक गुण क्या है कक्षा 12 physical properties of phenols class 12 in hindi ?
फीनोलों के सामान्य भौतिक गुण (Physical Properties of Phenols)
(1) शुद्ध फीनोल रंगहीन द्रव या क्रिस्टलीय ठोस होते हैं। वायु के सम्पर्क में इनका ऑक्सीकारण होने के कारण ये लाल गुलाबी रंग में परिवर्तित हो जाते हैं। फीनोल्स के क्वथनांक संगत ऐरोमैटिक हाइड्रोकार्बन एवं हैलोऐरीन्स की अपेक्षा काफी उच्च होते हैं क्योंकि इनमें अन्तराअणुक हाइड्रोजन बंध उपस्थित होते हैं।
(2) अधिकांश फीनोलों की लाक्षणिक गंध होती है।
(3) ये जल में अल्प विलेय या अविलेय होते हैं। परन्तु ऐल्कोहॉल और ईथर में शीघ्रता से घुल जाते हैं। ये अन्तराअणुक हाइड्रोजन बंध के कारण जल में विलेय होने चाहिए परन्तु बड़े आकार के हाइड्रोकार्बन के कारण इनकी विलेयता बहुत कम होती है क्योंकि हाइड्रोकार्बन भाग जल प्रतिकर्षी होते हैं। बड़े आकार के हाइड्रोकार्बन भाग के कारण ही ये कार्बनिक विलायकों में शीघ्रता से घुल जाते हैं।
(4) इनकी दुर्बल अम्लीय प्रकृति होती है और नीले लिटमस पत्र का रंग लाल कर देते हैं।
(5) इनमें अन्तराआण्विक हाइड्रोजन बंध उपस्थित होने के कारण इनका क्वथनांक का गलनांक उच्च होता है।
(6) फीनोलिक – OH समूह के o- स्थिति पर – NO2 या – COOH समूह उपस्थित होने पर इनका क्वथनांक अपेक्षाकृत कम होता है क्योंकि – OH समूह – NO एवं – COOH के साथ अन्तः आण्विक हाइड्रोजन बंध बना लेता है।
(7) फीनोल की अविषालु (Toxic) प्रकृति होती है और ये पूतिरोधी (Antiseptic) के रूप में प्रयुक्त होते हैं।
(8) U. V. स्पेक्ट्रा – बैंजीन की भांति फीनोल भी UV क्षेत्र में अवशोषण प्रदर्शित करते हैं। इन अवशोषक बैंडों के मान बैंजीन की तुलना में उच्च होते हैं। कुछ फीनॉल्स के
क्षारकीय विलयन में का मान और भी अधिक बढ़ जाता है। उदाहरणार्थ- फीनोल के क्षारीय विलयन में max
के मान 235mu एवं 287 mp है जो फीनोल के max के मान 210m से अधिक है।
(9) अवरक्त (1R) स्पेक्ट्रा अवरक्त स्पेक्ट्रॉ में तनन के कारण फीनोल बैंड प्रदर्शित करते हैं। इनमें C-0 तनन के कारण 1200 cm-1 और 1300-1410 cm-1 के मध्य भी अवशोषण बैंड प्राप्त होते है। इन
बैंडो की सही स्थिति बेंजीन वलय पर उपस्थित अन्य प्रतिस्थापियों पर निर्भर करती है।
फीनोल की अम्लीय प्रकृति (Acidic Nature of Phenols)
फीनोल एवं ऐल्कोहॉल दोनों में –OH समूह उपस्थित होता है। ऑक्सीजन तथा हाइड्रोजन की विद्युतऋणता में अन्तर होने के कारण दोनों प्रकार के यौगिक अम्लीय गुण दर्शाते हैं क्योंकि दोनों प्रकार के यौगिक विद्युतधनात्मक धातुओं (Na, K इत्यादि) से क्रिया करते हैं। फीनोल (Ka = 10-8-10-10 ऐल्कोहॉल (Ka = 10-16 – 10-18) की तुलना में अधिक अम्लीय होते हैं तथा कार्बोक्सिलिक अम्ल (Ka = 10- 5) की तुलना में कम अम्लीय होते हैं।
फीनोल की अम्लीय प्रकृति के कारण कुछ अभिक्रियायें निम्न प्रकार हैं-
(i) धातुओं के साथ धनविद्युती तत्व जैसे सोडियम, पौटेशियम आदि से फीनोल अभिक्रिया कर हाइड्रोजन देते है।
(ii) प्रबल क्षारों के साथ- प्रबल क्षारों के साथ फीनॉल, फीनॉक्साइड बनाता है।
(iii) ग्रीन्यार अभिकर्मक के साथ फीनोल ग्रीन्यार अभिकर्मक के साथ क्रिया करता है तथा ऐल्केन बनाता है।
(iv) लीथियम ऐलुमिनिमय हाइड्राइड के साथ फीनोल, लीथियम ऐलुमिनियम फीनॉक्साइड बनाता है ।
(v) फीनोल लाल लिटमस पत्र को नीला कर देते हैं।
उपर्युक्त सभी अभिक्रियायें फीनोल की अम्लीय प्रकृति दर्शाती हैं, जिसमें फीनोल के – OH समूह का H प्रतिस्थापित हो जाता है। फीनोल की अम्लीय प्रकृति के निम्नलिखित कारण हैं-
अनुनाद प्रभाव –
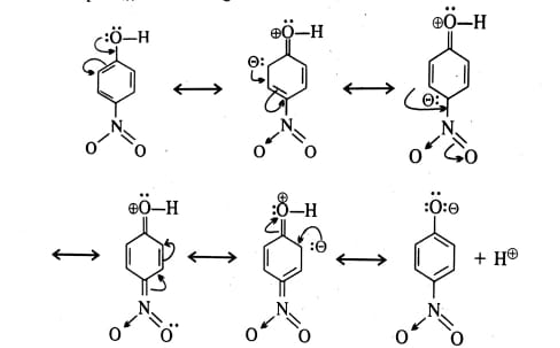
अनुनाद प्रभाव के कारण ऑक्सीजन परमाणु पर उपस्थित एक एकाकी इलेक्ट्रॉन युग्म बेंजीन वलय पर अस्थानीकृत हो जाता है। इस कारण से – OH समूह का ऑक्सीजन परमाणु धनावेशित हो जाता है और O-H बंध के इलेक्ट्रॉन ऑक्सीजन परमाणु की ओर आकर्षित हो जाते हैं। फलस्वरूप हाइड्रोजन परमाणु H® के रूप में अलग हो जाता है।
अतः फीनोल प्रोटॉन दाता के रूप में अम्लीय व्यवहार प्रदर्शित करते हैं।
अतः जलीय माध्यम में
इस प्रकार प्राप्त फीनॉक्साइड आयन अनुनाद के द्वारा फीनोल से भी अधिक स्थायी है। 3.6.2 फीनॉक्साइड आयन का अधिक स्थायित्व-
फनोल के आयनित होने के बाद प्राप्त फीनॉक्साइड आयन भी फीनोल की भांति अनुनादी संरचनाओं (VI-X) का अनुनादी संकर होता है। फीनॉक्साइड आयन फीनोल की अपेक्षा अधिक स्थाई होता है क्योंकि इसमें केवल ऋणात्मक आवेश का ही विक्षेपण होता है जबकि अनआयनित फीनोल में विपरीत आवेशों का विक्षेपण होता है।
फनोल की अम्ल सामर्थ्य की ऐल्कोहॉल से तुलना
फीनोल की अम्ल सामर्थ्य ऐल्कोहॉल की तुलना में अधिक होती है। ऐल्कोहॉल में अनुनाद प्रभाव उपस्थित नहीं होता है जिसके कारण से O-H समूह द्वारा हाइड्रोजन परमाणु को H के रूप में त्यागने की प्रवृत्ति कम होती है अतः ऐल्कोहॉल जलीय क्षार से क्रिया नहीं करते हैं। ऐल्कॉक्साइड आयन पर औपचारिक ऋणावेश होने के कारण इसकी ऊर्जा ऐल्कोहॉल से अधिक होती है अर्थात स्थायित्व ऐल्कोहॉल से कम होता है अतः ऐल्कोहॉल सामान्यतः आयनित नहीं होते।
ROH + OH© _*→ RO® + H2O
ऐल्कोहॉल का लिटमस पत्र पर कोई प्रभाव नही पड़ता है। फीनोल के Ka के मान 10-8-10-10 और ऐल्कोहॉल के Ka मान 10-16-10-18 होते हैं।
फीनोल की अम्ल सामर्थ्य कार्बोक्सिलिक अम्ल की तुलना में बहुत ही कम होती है। अतः यह सोडियम कार्बोनेट को तो अपघटित कर देता है परन्तु सोडियम हाइड्रोजन कार्बोनेट को अपघटित नहीं कर पाता है। इस अभिक्रिया द्वारा फीनोल और कार्बोक्सिलिक अम्ल में विभेद किया जा सकता है।
प्रबल क्षार जैसे NaOH के साथ फीनोल अभिक्रिया करके लवण बनाता है। ये लवण जल में घुलनशील होते हैं। लवण के जलीय विलयन में कार्बन डाइऑक्साइड प्रवाहित करने पर फीनोल फिर से प्राप्त हो जाता है जिसे ईथर में घोलकर जल से अलग किया जा सकता है जबकि कार्बोक्सिलिक अम्ल के सोडियम लवण का कार्बन डाइऑक्साइड से विघटन नहीं होता है।
इस विधि से फीनोल एवं कार्बोक्सिलिक अम्ल के मिश्रण को अलग किया जा सकता है।
C6H5ONa + CO2 + H2O CHOH + NaHCO3
3.6.3 फीनोल की अम्ल सामर्थ्य पर अन्य समूहों का प्रभाव-
बेंजीन वलय पर हाइड्रॉक्सी समूह के अतिरिक्त अन्य समूह की उपस्थिति से फीनोल की अम्ल सामर्थ्य पर बहुत प्रभाव पड़ता है।
(i) ऋण विद्युती समूह (electro negative groups ) या इलेक्ट्रॉन को अपनी ओर आकर्षित करने वाले समूह (electron withdrawing groups ) जैसे NO, CN, – CI, COOR आदि. बेंजीन वलय पर उपस्थित हो तो फीनोल की अम्ल साम्थर्य बढ़ जाती है इसका मुख्य कारण यह है कि ये समूह ऑक्सीजन से इलेक्ट्रॉन को अपनी ओर आकर्षित करते हैं जिससे O-H समूह से प्रोटोन (H+) के अलग होने की सभावनायें अधिक हो जाती है। फीनॉक्साइड आयन पर उपस्थित ऋणात्मक आवेश का विक्षेपण भी अनुनाद प्रभाव से बढ़ जाता है जिससे फीनॉक्साइड आयन का स्थायित्व बढ़ता है और फीनोल का
आयनन बढ़ जाता है।
उदाहरणार्थ- p-नाइट्रोफीनोल में अनुनाद निम्न प्रकार होता है
इस प्रकार प्राप्त p-नाइट्रोफीनॉक्साइड आयन अनुनाद के द्वारा निम्न प्रकार स्थायी हो जाता है।
यदि ऋणविद्युती समूह बेंजीन वलय में – OH समूह के ऑर्थो एवं पैरा स्थिति पर उपस्थित हो तो फीनोल की अम्ल सामर्थ्य मेटा समावयवी से अधिक होती है। पैरा प्रतिस्थापित फीनोल (p-substituted phenol) आर्थो प्रतिस्थापित फीनोल (o- substituted phenol) से अधिक अम्लीय होते हैं। इसका मुख्य कारण है पैरा प्रतिस्थापित फीनोल में अंतः अणुक (Intra molecular) हाइड्रोजन बंध का न होना। 0- प्रतिस्थापित फीनोल में अन्तः अणुक हाइड्रोजन बन्ध उपस्थित होने के कारण O-H समूह से हाइड्रोजन की H+ के रूप में अलग होने की प्रवृत्ति कम होती है।
अतः अम्ल सामर्थ्य का क्रम p-नाइट्रोफीनोल > – नाइट्रोफीनॉल > m नाइट्रोफीनोल फीनोल o- एवं p-स्थितियों पर इलेक्ट्रॉन आकर्षी समूहों की संख्या बढ़ने पर फीनोल की अम्ल सामर्थ्य बढ़ती है। उदाहरणार्थ- अम्लीयता क्रम-
2,4,-6 ट्राइनाइट्रोफीनोल > 2, 4- नाइट्रोफीनोल > 2 या 4 नाइट्रोफीनोल > फीनोल
(ii) यदि इलेक्ट्रॉन दाता समूह ( Electron releasing groups ) जैसे – NH2, – NHR, OR (ऐल्कॉक्सी), ऐल्किल आदि बेंजीन वलय में उपस्थित हों तो फीनोल की अम्ल सामर्थ्य कम हो जाती है।
इलेक्ट्रॉन दाता समूह (electron releasing group) के द्वारा अपनी ओर से बेंजीन वलय को इलेक्ट्रॉन देने के कारण बेंजीन वलय पर तथा ऑक्सीजन परमाणु पर इलेक्ट्रॉन घनत्व अधिक हो जाता है। इलेक्ट्रॉन दाता समूह फीनॉक्साइड आयन पर ऋणावेश के स्थानीकरण को बढ़ाकर उसे अस्थायी कर देते हैं जिससे -OH समूह से हाइड्रोजन परमाणु के H के रूप में निकलने की सम्भावनायें कम हो जाती है।
उदाहरणार्थ- यह प्रभाव – OH समूह के o- एवं p स्थितियों पर m- की अपेक्षा अधिक होता है। अत: क्रिसॉल की अम्ल सामर्थ्य का क्रम निम्न प्रकार है।
फीनोल > m-क्रीसोल > p-क्रीसोल > क्रीसोल
m- मेथॉक्सी फीनोल और mऐमीनोफीनोल की अम्ल सामर्थ्य फीनोल से अधिक है। इनके अम्ल सामर्थ्य का क्रम निम्न प्रकार है।
m- मेथॉक्सी फीनोल > फीनोल > 0 मेथॉक्सीफीनोल > p- मेथॉक्सीफीनोल
कुछ यौगिकों के वियोजन स्थिरांक (dissociation constant) Kg निम्नानुसार है जिससे फीनोल एवं प्रतिस्थापित फीनोल की अम्ल सामर्थ्य को समझा जा सकता है।
फीनोल की रासायनिक अभिक्रियायें (Chemical Reactions of Phenol )
फीनोलिक (हाइड्रॉक्सी) समूह की अभिक्रियायें –
(1) अम्लीय प्रकृति- इसके विषय में खण्ड 3.6 में विस्तार से वर्णन किया गया है।
(2) एस्टरीकरण (Estrification) या O ऐसीलीकरण (O acetylation)- फीनोल, NaOH, पिरिडी अथवा सान्द्र HSO अम्ल की उपस्थिति में ऐसीटिल क्लोराइड या ऐसिटिक एनहाइड्राइड के अभिक्रिया करके एस्टर बनाते हैं।
क्रियाविधि – (i) क्षारीय माध्यम में अभिक्रिया की क्रियाविधि निम्न प्रकार से दी जा सकती है-
(ii) अम्लीय माध्यम में अभिक्रिया निम्न प्रकार होती है-
(3) बेंजॉयलीकरण (Benzoylation)- फीनोल, बेंजॉयल क्लोराइड, के साथ अभिक्रिया करके फेनिल बेंजोऐट बनाता है।
(4) ईथरीकरण (Etherification) अथवा 0 ऐल्किलीकरण (O- alkylation)- सोडियम या पोटैशियम फीनॉक्साइड को ऐल्किल बैलाइड के साथ या दुर्बल क्षारीय विलयन में फीनोल की डाइऐल्किल सल्फेट के साथ अभिक्रिया से ऐल्किल ऐरिल ईथर प्राप्त होते हैं।
क्लेजन पुनर्विन्यास (Claisen Rearrangement)- यदि ऐलिल ऐरिल ईथर को 200°C ताप पर गर्म किया जाता है तो ऐलिल समूह का बेंजीन वलय में o-स्थिति पर विस्थापन हो जाता है। यदि ०-स्थिति पर पहले से कोई समूह उपस्थित है तो ऐलिल समूह का विस्थापन p- स्थिति पर हो जाता है। इस अभिक्रिया को क्लेजन पुनर्विन्यास अभिक्रिया (Claisen rearrangement reaction) कहते हैं।
क्रिया-विधि- हर्ड (1937) ने क्लेजन पुनर्विन्यास को अन्तः आण्विक पुनर्विन्यास (Interamolecular Rearrangement) बताया। इसके लिए उसने ऐलिल – 2- नेपिथल ईथर एवं सिन्नेमिल फेनिल ईथर के मिश्रण को गर्म किया। अभिक्रिया के फलस्वरूप क्रॉस उत्पादू प्राप्त नहीं हुए ।
किनसैड (1939) ने इसे प्रथम कोटि की अभिक्रिया बताया और श्मिड (Schmid, 1953) ने यह सिद्ध किया कि जब ऐलिल समूह का o स्थिति पर विस्थापन होता है तो ay-बंधन उलट जाता है जैसा कि ऊपर दिये गये उदाहरणों से स्पष्ट है।
इन उपर्युक्त परिणामों के आधार पर क्लेजन पुनर्विन्यास की क्रिया विधि को निम्न प्रकार दिया जा सकता है।
(5) FeCI3 के साथ (With FeCl3)- उदासीन या बहुत दुर्बल अम्लीय फेरिक क्लोराइड का विलयन फीनोल के साथ लाक्षणिक रंग का जटिल यौगिक बनाते हैं। यह अभिक्रिया फीनोल के परीक्षण में होती है। उदाहरणार्थ, फीनोल (CH, OH) बैंगनी रंग, कैटिकॉल हरा रंग, रिसॉर्सिनॉल बैंगनी रंग पाइरोगैलोल लाल रंग देते हैं।
(6) जिंक चूर्ण के साथ (With zinc dust)- जब फीनोल को जिंक चूर्ण के साथ आसवित किया जाता है तो बेंजीन प्राप्त होती है।
CqH5OH + Zn → C6H6 + ZnO
(7) अमोनिया के साथ (With ammonia)- फीनोल को अमोनिया के साथ निर्जल ZnC2 की उपस्थिति में 300°C ताप पर गर्म करने पर ऐनिलीन प्राप्त होती है।
(8) फास्फोरस पेन्टाक्लोराइड के साथ (With phosphorous pentachloride)- फीनोल PCI से अभिक्रिया करके कम मात्रा में क्लोरो बेंजीन बनाता है किन्तु मुख्य उत्पाद ट्राई फेनिल फॉस्फेट बनाता है।
फीनोल पर हाइड्रोक्लोरिक अम्ल की कोई अभिक्रिया नहीं होती है।
(9) ऑक्सीकरण (Oxidation)- (i) फीनोल का क्रोमिल क्लोराइड (CO2 Cl) से p-बेंजोक्विनॉन में ऑक्सीकरण हो जाता है।
फीनॉल का लाल, गुलाबी अथवा भूरा रंग संभवतः इन्हीं क्विनोन तथा फीनोक्विनोन के निर्माण के कारण होता है।
(ii) एल्बस परसल्फेट ऑक्सीकरण (Elbs persulphate oxidation)
मोनोहाइड्रिक फीनोल का क्षारीय पोटैशियम पर सल्फेट के द्वारा ऑक्सीकरण करने पर डाइहाइड्रिक फीनोल प्राप्त होते हैं। हाइड्रॉक्सिलीकरण p-स्थिति पर होता है। यदि p-स्थिति पहले से भरी है तो हाइड्रॉक्सिलीकरण o- स्थिति पर होता है। अभिक्रिया की क्रियाविधि निम्न प्रकार दी जा सकती है-
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics