photochemistry in hindi reaction प्रकाश रासायनिक अभिक्रिया किसे कहते हैं उदाहरण सहित समझाइए
प्रकाश रासायनिक अभिक्रिया किसे कहते हैं उदाहरण सहित समझाइए photochemistry in hindi reaction definition types example ?
अध्याय प्रकाश रसायन (PHOTO-CHEMISTRY)
परिचय (Introduction)
रासायनिक अभिक्रिया में अणु की प्रकृति ( Identity) बंध के टूटने से व बनने से बदलती है। साधारणतया रासायनिक अभिक्रिया के लिए आवश्यक ऊर्जा बाह्य स्रोत से दी जाती है इस ऊर्जा को ऊष्मा ऊर्जा (Thermal energy) कहते हैं तथा इस प्रकार की रासायनिक अभिक्रियाओं को ऊष्मा अभिक्रिया (Thermal or Dark Reactions) भी कहते हैं। लेकिन कुछ अभिक्रियाऐं प्रकाश की उपस्थिति में होती है अर्थात् वे प्रकाश ऊर्जा ग्रहण करती है अर्थात् ये अभिक्रियाऐं प्रकाश ऊर्जा के ग्रहण या अवशोषण के बिना प्रारम्भ नहीं हो सकती उनको प्रकाश रासायनिक अभिक्रिया (Photo chemical reactions) कहते हैं।
अतः रसायन में अणु द्वारा उचित विकिरणों के अवशोषण से अणु के भौतिक या रासायनिक परिवर्तन के अध्ययन को प्रकाश रसायन कहते हैं।
सामान्यतः इसमें वे सभी विकिरण जो रेडियो तरंग से y- किरण के बीच के होते हैं उनका अध्ययन करते हैं। लेकिन विशेष रूप से प्रकाश के अवरक्त, पराबैंगनी व दृश्य प्रकाश के विकिरण के अवशोषण द्वारा जो परिवर्तन होते हैं उनका अर्थात् 102 nm से 103 nm या 200 nm से 800nm (2000 Å से 8000A). (35-75 किलो कैलोरी) के मध्य अवशोषण से जो परिवर्तन होते हैं उनका अध्ययन करते हैं।
अतः वे रासायनिक परिवर्तन जो प्रकाश के 200 nm से 800nm के मध्य विकिरणों के अवशोषण से होते हैं उन्हें प्रकाश रसायन कहते हैं तथा प्रकाश रासायनिक अभिक्रियाऐं वे हैं जो प्रकाश विकिरणों केफोटानों के अवशोषण के फलस्वरूप घटित होती हैं। सामान्यतः 200nm से 800nm के मध्य की ऊर्जा अणु के इलेक्ट्रॉनों के उत्तेजन के लिए उपयुक्त है जो रासायनिक अभिक्रिया में भाग ले सके।
इस प्रकार प्रकाश रसायन रसायन शार की वह शाखा है जिसमें प्रकाश विकिरणों फोटोन (photon) के अवशोषण फोटोन (photor) से प्रकाश रासायनिक अभिक्रियाओं की दर, क्रियाविधि आदि का अध्ययन किया जाता है। उच्च ऊर्जा विकिरणों X-किरण, y-किरण, आदि द्वारा सम्पन्न रासायनिक अभिक्रियाओं के अध्ययन को विकीरण रसायन (radiation chemistry) कहा जाता है। प्रकाश विकिरणों से कई प्रकार की अभिक्रियाऐं जैसे संश्लेषण, बहुलीकरण, आइसोमेटिक परिवर्तन, ऑक्सीकरण, अपचयन आदि सम्पन्न होती हैं। आज के वैज्ञानिक एवं तकनीक युग में प्रकाश रसायन का महत्व एवं उपयोग बहुत अधिक है जैसे फोटो वोल्टिक सैलों द्वारा वैद्युत उत्पादन, जल का शुद्धीकरण, विटामीन D2 का संश्लेषण, कीटनाशकों का निर्माण, पर्यावरण संरक्षण, सौर ऊर्जा संरक्षण तथा मानव जीवन के लिए उपयोगी पदार्थों के निर्माण में प्रकाश रसायन की अहम् भूमिका है।
इन अभिक्रियाओं द्वारा उत्पन्न उत्पाद मानव उपयोगी के साथ पर्यावरण को भी प्रदूषित नहीं करता है तथा अभिक्रिया के लिए ऊर्जा का खर्च भी बहुत कम होता है।
विकिरण का पदार्थ से संयोग (Interaction of radiation with matter)
रासायनिक अभिक्रियाऐं आणविक स्तर पर होती हैं और प्रत्येक अणु की इलेक्ट्रॉनिक, कम्पन एवं घूर्णन ऊर्जा होती है। अतः अणु में इलेक्ट्रोनिक, कम्पन एवं घूर्णन ऊर्जा स्तर भी होते हैं ये सभी ऊर्जा से क्वाटीकृत होते हैं। यदि कोई अणु पराबैंगनी या दृश्य प्रकाश के फ़ोटान (200 nm से 800 nm के मह य) अवशोषण करता है और वह उत्तेजित अवस्था में (उच्च इलेक्ट्रॉनिक ऊर्जा स्तर में पहुंच जाता उसके बाद जो अभिक्रिया सम्पन्न होती है उनका अध्ययन ही प्रकाश रसायन है।
इलेक्ट्रॉनिक रूप में उत्तेजित अणुओं (फोटान के अवशोषण द्वारा) के रसायन को प्रकाश रसायन कहते हैं।
A +hv → A * उत्पाद
पदार्थ विकिरण उत्तेजित अवस्था
रासायनिक अभिक्रियाओं के प्रकार (Types of Photo- Chemical Reactions) रासायनिक अभिक्रियाऐं जिसमें अणु के बंध के टूटने या बनने से उसकी पहचान समाप्त हो जाती है व नया उत्पाद बनता है ये अभिक्रियाऐं मुख्य रूप से निम्न हैं-
(i) ऊष्मा ऊर्जा अभिक्रिया
(ii) प्रकाश रासायनिक अभिक्रिया
ऊष्मा ऊर्जा अभिक्रिया (Dark Reaction or Thermal Reactions)
वे रासायनिक अभिक्रियाऐं जो प्रकाश की अनुपस्थिति में होती है उन्हें ऊष्मा ऊर्जा या अन्धेरे की या अदीप्त अभिक्रिया कहते हैं। अतः ये अभिक्रियाऐं ताप, अभिकारक की सान्द्रता, उत्प्रेरक के द्वारा सम्पन्न होती है।
जैसे
इनके गुण निम्न प्रकार है
(i) सक्रियण के लिए टक्कर का होना आवश्यक
(ii) इनकी दर ताप पर निर्भर करती है
(iii) इनके होने पर मुक्त ऊर्जा में कमी होती है।
प्रकाश रासायनिक अभिक्रिया ( Photo- Chenical Reactions)
वे रासायनिक अभिक्रिया वैद्युत चुम्बकीय स्पेक्ट्रम के 200 nm से 800 nm के मध्य क्षेत्र (दृश्य पराबैंगनी) के विकिरणों के अवशोषण से सम्पन्न होती है। इसमें सक्रियण ऊर्जा विकिरणों के अवशोषण से प्राप्त होती है। अतः अभिक्रिया की दर ताप पर निर्भर नहीं करती। प्रकाश रासायनिक अभिक्रिया में क्रियाकारी मिश्रण में कोई स्पीशीज प्रकाश विकिरण से ऊर्जा ग्रहण कर उच्च इलेक्ट्रॉनिक ऊर्जा स्तर में पहुंच जाते हैं जबकि ऊष्मा ऊर्जा से अभिक्रिया में सभी उपस्थित अणुओं की (स्पिशीज की ) स्थानान्तरण ऊर्जा (Translational energy) में वृद्धि होती है।
प्रकाश रासायनिक अभिक्रियाओं के उदाहरण निम्न है-
(1)
विघटन 2HBr + hv ===> H2 + Br2
प्रकाश रासायनिक अभिक्रियाओं के गुण
(1) इनमें सक्रियण के लिए टक्कर नहीं होती।
(2) ये ताप पर निर्भर नहीं करती इनमें क्रिया की दर प्रकाश के फोटान के अवशोषण की मात्रा पर निर्भर करती है।
ऊष्मा ऊर्जा अभिक्रिया व प्रकाश रासायनिक अभिक्रिया में अंतर
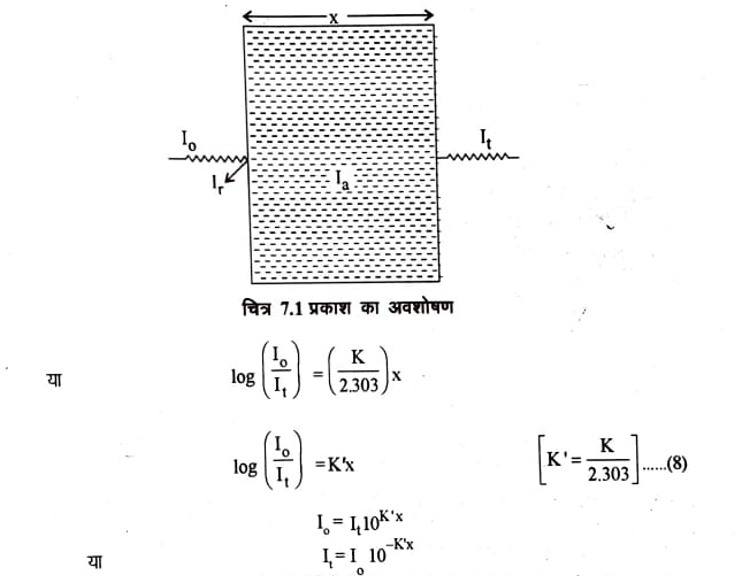
प्रकाश का अवशोषण (Absorption of Light)
प्रकाश अवशोषण के नियम (Laws of Light Absorption) जब एक वर्णी प्रकाश किरण एक संमागी माध्यम से टकराती है तो उस विकिरण का कुछ भाग माध्यम द्वारा परावर्तित (reflected), कुछ भाग अवशोषित (absorbed) तथा शेष भाग पारगत (transmitted) हो जाता है। अर्थात्
जहां I. आपतित विकिरण की तीव्रता I = परावर्तित विकिरण, I = अवशोषित प्रकाश, I, = पारगम्य प्रकाश विकिरण की तीव्रता है। यह देखा गया है कि I का मान बहुत ही कम (लगभग 4%) होता है। इसलिये इसे नगण्य माना जा सकता है अतः
लैम्बर्ट के अनुसार अवशोषण, विलयन में उपस्थित स्पीशीज तथा उसकी सान्द्रता पर निर्भर करता है, जो इस प्रकार है-
लैम्बर्ट नियम (Lambert Law)
लैम्बर्ट ने 1760 में यह नियम प्रतिपादित किया। इसके अनुसार जब एक वर्णी (mono chromatic) प्रकाश की समानान्तर किरण किसी संमागी पारदर्शी अवशोषण करने वाले माध्यम से गुजरती है (लम्बवत् गिरती है) तो अवशोषी माध्यम में प्रकाश पथ की लम्बाई के साथ प्रकाश की तीव्रता में कमी की दर आपतित किरण की तीव्रता के समानुपाती होती है। अर्थात् एक से माध्यम में किसी वस्तु की बराबर मोटाई (equal fractions) की परतें हमेशा वस्तु पर गिरने वाले प्रकाश का बराबर भाग (equal fractions) अवशोषित करती है।
यहां I, तरंग दैर्ध्य वाली आपतित किरण पुंज की तीव्रता है तथा dI तीव्रता में होने वाला अनंत सूक्ष्म परिवर्तन है जबकि प्रकाश अवशोषक माध्यम में अनन्त सूक्ष्म दूरी dx तय कर लेता है। K एक समानुपाती स्थिरांक है जो अवशोषी पदार्थ की प्रकृति पर निर्भर होता है जिसे अवशोषण गुणांक (Absorption coefficient) कहते हैं। बांई और ऋणात्मक चिन्ह यह प्रदर्शित करता है कि जैसे-जैसे x का मान बढ़ता है I का मान घटता है। समीकरण (4) को निम्न प्रकार भी व्यक्त कर सकते हैं-
यहां पर K’ एक दूसरा स्थिरांक है जिसे विलोप गुणांक या विलोपन गुणांक (Extinction Coefficient) कहते हैं। पद
को विलोपन (Extinction) या अवशोषणांक (Absorbance) या प्रकाशिक घनत्व (Optical density) कहते हैं। इसे A या D द्वारा अभिव्यक्त किया जाता है। अर्थात्
लेम्बर्ट नियम को इस प्रकार भी परिभाषित कर सकते हैं।
जब एक वर्णी प्रकाश की समानान्तर किरण पुंज किसी अवशोषक पदार्थ में अभिलम्ब प्रवेश करती है तो अवशोषणांक किरण पुंज द्वारा तय की गई दूरी के समानुपाती होते हैं।
इसी प्रकार किसी नमूने (मोटाई x वाला) द्वारा पारगत (transmitted) विकिरण तीव्रता तथा आपतित विकिरण तीव्रता के अनुपात को पारगम्यता (transmittance) कहते हैं और इसे T द्वारा प्रदर्शित करते. हैं। अतः
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics