partially miscible liquids example in hindi आंशिक रूप से मिश्रणीय द्रव क्या है उदाहरण
आंशिक रूप से मिश्रणीय द्रव क्या है उदाहरण partially miscible liquids example in hindi ?
एनिलीन- हेक्सेन तंत्र (Aniline Hexane System) :- ऐनिलीन तथा हेक्सेन सामान्य ताप पर आंशिक रूप से मिश्रणीय द्रव है। यदि हेक्सेन की थोड़ी सी मात्रा ऐनिलीन में मिलाई जाती है तो एक समांगी विलयन प्राप्त होता है। धीरे-धीरे यदि हेक्सेन की मात्रा बढ़ाई जाती है तो एक निश्चित सीमा
के पश्चात दो संयुग्मी विलयनों की परतें प्राप्त होती है। एक विलयन हेक्सेन का ऐनिलीन में है, जबकि दूसरा ऐनिलीन का हेक्सेन में। इन संयुग्मी विलयनों के संघटन (Composition) को ताप के विरूद्ध आलेखित किया जाये तो चित्र 4.22 के अनुसार वक्र ACB प्राप्त होता है।
जैसे-जैसे ताप बढ़ाया जाता है, दोनों द्रवों की परस्पर विलेयता बढ़ती जाती है। बिन्दु C पर दोनों विलयनों का संघटन एक-समान हो जाता है, अर्थात् दोनों द्रव एक दूसरे में पूर्ण रूप से मिश्रणीय हो जाते हैं। यह ताप (59.6°C) इस तंत्र का क्रान्तिक विलयन ताप (T) अथवा संविलयन ताप कहलाता है। इस ताप तथा इससे ऊपर के तापों पर ऐनिलीन हेक्सेन सभी अनुपात में मिश्रणीय होते हैं।
इस तंत्र में भी वाष्प प्रावस्था की उपेक्षा की जाती है. अर्थात् इसका अध्ययन स्थिर दाब पर किया जाता है तथा प्रावस्था नियम का संशोधित रूप (FC – P + 1 ) ही काम में लिया जाता है। इस तंत्र की प्रमुख विशेषताएं निम्नलिखित है।
. वक्र AC तथा BC :- ये वक्र क्रमशः हेक्सेन की ऐनिलीन में तथा ऐनिलीन की हेक्सेन में विलेयता दर्शाती है। इन चक्रों पर दो प्रावस्थाऐं साम्यवस्था में रहती है, ( P = 2) चूंकि यह द्विघटक तंत्र है. (C = 2 ) अतः तंत्र की स्वातन्त्र्य कोटि एक ( F = 1 ) होगी और तंत्र एक चर कहलायेगा ।
F=C-P+1
F=2-2+1
F= 1.
वक्र ACB के बाहर का क्षेत्र: इस क्षेत्र में प्रत्येक बिन्दु पर केवल एक ही प्रावस्था होगी क्योंकि इस क्षेत्र में ऐनिलीन तथा हेक्सेन पूर्ण रूप से मिश्रणीय है। इस क्षेत्र में स्वातंत्र्य कोटि दो होगी अर्थात तंत्र द्विचर है।
P=1; C=2
F=2-1+1=2
अतः इस क्षेत्र में तंत्र को व्यक्त करने के लिये ताप व संघटन दोनों की ही आवश्यकता होती है। वक्र ACB के अन्दर का क्षेत्र:- इस क्षेत्र में सभी बिन्दुओं पर दो प्रावस्थायें होगी। इन दोनों प्रावस्थाओं का संघटन एक टाई रेखा खींच कर ज्ञात किया जा सकता है। माना कि वक्र ACB के अन्दर कोई बिन्दु X है । बिन्दु X पर दो विलयन साम्यवस्था में होंगें। बिन्दु X से एक टाई रेखा YZ खींचने पर यह वक्र ACB को Y तथा Z बिन्दुओं पर काटती है तथा ताप अक्ष को t°C पर काटती हैं। अतः इन दोनों विलयनों के संघटन Y तथा Z द्वारा प्रदर्शित किये जाते हैं। इन दोनों विलयनों की आपेक्षिक मात्रा में सम्बन्ध निम्न प्रकार से दिया जा सकता है।
यदि बिन्दु X बिन्दु Z के अधिक निकट है तो Z संघटन के द्रव का अनुपात अधिक होगा और यदि बिन्दु X बिन्दु Y के अधिक निकट है तो Y संघटक के द्रव का अनुपात अधिक होगा। इस प्रकार वक्र ACB के अन्दर के क्षेत्र में-
अतः
P=2;C=2
F=2-2+1=1
अर्थात् तंत्र एक-चर होगा। केवल ताप ही टाई रेखा द्वारा दोनों प्रावस्थाओं के संघटन को व्यक्त कर सकता है।
तंत्र में कुछ अन्य महत्वपूर्ण प्रेक्षण- (i) एक बिन्दु K जो कि वक्र ACB के बाहर है पर ध्यान दीजिये। इस बिन्दु पर तंत्र में केवल एक प्रावस्था है। ताप कम करने पर यह बिन्दु KL रेखा के सहारे चलेगा। बिन्दु L पर दूसरी प्रावस्था प्राप्त होती है, जिसका संघटन बिन्दु M द्वारा प्रदर्शित किया जाता है। यदि तंत्र का ताप और घटाया जाता है तो दोनों प्रावस्थाओं का संघटन वक्र LA तथा MB की और बढ़ेगा।
(ii) माना कि एक तंत्र बिन्दु D द्वारा प्रदर्शित किया जाता है इस बिन्दु पर हेक्सेन का असंतृप्त विलयन है। यदि स्थिर ताप पर इस विलयन में हेक्सेन की मात्रा बढ़ाई जाती है तो बिन्दु DA ऐनिलीन की दिशा में बढ़ता है। बिन्दु A पर विलयन हेक्सेन का ऐनिलीन में संतृप्त विलयन होगा तथा एक दूसरी परत दिखाई देने लगेगी जो कि ऐनिलीन का हेक्सेन में विलयन है। इस बिन्दु के बाद और अधिक हेक्सेन मिलाई जाती है तो दूसरी परत का अनुपात बढ़ता जाता है परन्तु दोनों परतों का संघटन स्थिर रहता है यदि हेक्सेन को अत्यधिक मात्रा में मिलाया जाता है तो ऐनिलीन का हेक्सेन में समांगी विलयन (केवल एक प्रावस्था) प्राप्त होता है जो बिन्दु E द्वारा प्रदर्शित किया गया है।
बिन्दु D से E तक दो प्रावस्थाएँ प्राप्त किये बिना भी पहुँचा जा सकता है। बिन्दु D पर फिर से विचार कीजिये। यहाँ हैक्सेन का ऐनिलीन में असंतृप्त विलयन है। इस विलयन का ताप संविलयन ताप (59.6°C) से अधिक बिन्दु G तक बढ़ाया जाता है। इस ताप पर हेक्सेन तब तक मिलाई जाती है जब तक कि विलयन का संघटन F के समान हो जाये, फिर विलयन को बिन्दु E तक के ताप पर ठंडा कर लिया जाता है। इस प्रकार पथ DGFE द्वारा दो प्रावस्था प्राप्त किये बिना बिन्दु E तक पहुँचा जा सकता है।
(iii) वक्र ACB के बाहर एक बिन्दु / इस प्रकार से लिया जाता है कि उस पर तंत्र का ताप C से अधिक तथा संघटन C के समान हो। यदि इस समांगी विलयन को धीरे-धीरे ठंड़ा किया जाता है तो संविलयन ताप (C) पर पहुँचने पर एक नीला कुहरा सा दिखाई देने लगता है यह घटना क्रान्तिक दुग्विलता (CriticalOpalescence) कहलाती है। ताप C से कम करने पर विलयन दो परतों में बंट जाता है।
आंशिक रूप से मिश्रणीय द्रव (Partially miscible liquids)
कुछ ऐसे द्रव युग्म होते हैं जो कि दूसरे में एक निश्चित सीमा तक ही विलेय होते हैं। ये द्रव आंशिक रूप से मिश्रणीय द्रव (Partially miscible liquids) कहलाते हैं। उदाहरण के लिये फीनोल-जल; ऐनीलीन-जल; ऐथिल मेथिल कीटोन – जल आदि। इन द्रव युग्मों को तीन भागों में बांटा जा सकता है। प्रत्येक का संक्षिप्त विवरण निम्न प्रकार है।
वे द्रव-युग्म जिनका क्रान्तिक विलयन ताप उच्च हो
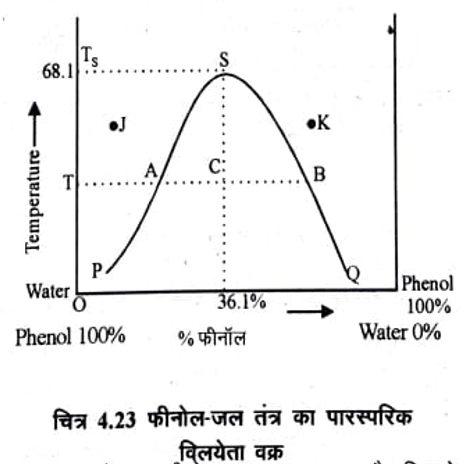
(Liquid pair with Upper Critical Solution Temperature) इस प्रकार के विलयन युग्म का उदाहरण फीनोल-जल है। सामान्य ताप पर यदि फीनोल की थोड़ी सी मात्रा जल में डाली जाती है तो वह पूर्ण रूप से घुल जाता है। धीरे-धीरे फीनोल की मात्रा बढ़ाने पर एक ऐसी स्थिति आती है जबकि फीनोल का घुलना बंद हो जाता है और दो द्रव सतह पृथक हो जाती है। ऊपर की सतह फीनोल का जल में संतृप्त विलयन है, जबकि नीचे की सतह जल का फीनोल में संतृप्त विलयन है। जब तक ताप में निश्चित रहता है दोनों सतहों का संघटन भी समान रहता है, जो कि चित्र 4.23 में क्रमशः बिन्दु P तथा Q से दर्शाया गया है। इस अवस्था में कुछ फीनोल अथवा कुछ जल और मिलाने पर दोनों विलयनों की मात्राएँ बदल जाती है, परन्तु उनका संघटन परिवर्तित नहीं होता | चित्र में PS फीनोल की जल में विलेयता वक्र तथा QS जल की फीनोल में विलेयता वक्र है जो विभिन्न ताप पर उनकी पारस्परिक विलेयता (Mutual solubilities) को दर्शाती है। वक्र PS के बायीं ओर के किसी बिन्दु
J पर द्रव की एक ही सतह होगी और यह फिनॉल का जल में असंतृप्त विलयन है। जबकि वक्र QS विलयन है। किसी ताप T पर बिन्दु A तथा B दोनों परतों में फिनोल जल का संघटन दशति है। A तथा के दायीं ओर के किसी बिन्दु K पर भी द्रव की एक ही सतह होगी और यह जल का फिनॉल में असंतृप्त B पर क्रमश: फीनोल का जल में तथा जल का फिनोल में संभागी विलयन होते हैं। इसे टाईलाइन कहते हैं। AB के मध्य कोई बिन्दु (C) दो द्रव प्रावस्था दर्शायेगा जिसका संघटन क्रमश: A तथा B द्वारा दर्शाया जायेगा ।
दोनों परतों की तुलनात्मक मात्रा निम्न समीकरण द्वारा मापी जा सकती है।
जैसे-जैसे ताप बढ़ाया जाता है, फीनोल की जल में तथा जल की फीनोल में विलेयता बढ़ती जाती है अर्थात् इनकी पारस्परिक विलेयता (Mutual Solubility) बढ़ती है और बिन्दु A तथा B बिन्दु S का ओर बढ़ने लगते हैं। वक्र के उच्चतम बिन्दु s पर दोनों परतों का संघटन समान हो जाता है और विलयन संमागी हो जाता है| इस तंत्र में यह ताप 68°C तथा संघटन 36% फीनोल (भार से) होता है। इस ताप तथा इससे अधिक ताप पर फीनोल तथा जल प्रत्येक अनुपात में मिश्रणी होते हैं। यह क्रान्तिक विलयन ताप (Critical Solution Temperature) अथवा संविलयन ताप (Consolute temperature) कहलाता है। इस ताप पर विलयन का संघटन 36.10% फिनॉल तथा 63.9% हो जाता है। इस प्रकार के अन्य द्रव – युग्म निम्न सारणी 4.10 में दर्शाये गये हैं।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics