Measurement of Infrared spectrum in hindi अवरक्त स्पेक्ट्रम का मापन क्या है समझाइये उदाहरण
अवरक्त स्पेक्ट्रम का मापन क्या है समझाइये उदाहरण Measurement of Infrared spectrum in hindi ?
अवरक्त स्पेक्ट्रम का मापन (Measurement of Infrared spectrum) –
गैसीय एवं द्रव पदार्थ का अवरक्त स्पेक्ट्रम प्राप्त करने के लिए उसे सीजीयम आयोडाइड के सैल में लेते हैं जबकि ठोस पदार्थ का स्पेक्ट्रम प्राप्त करने के लिए या तो उसकी पोटैशियम ब्रोमाइड के साथ पैलेट (लगभग 1mg पदार्थ को 100 मिग्रा. KBr के साथ पीसने के उपरान्त लगभग 1-2 cm मोटी व I cm व्यास की डिस्क बनाते हैं) अथवा न्यूजोल मूल (Nujol Mull) (लगभग 5mg पदार्थ को 2 बूँद न्यूजोल से रगड़ कर सीजीयम आयोडाइड की पट्टिका पर पतली फिल्म बना लेते हैं।) के रूप में लिया जाता है। पोटैशियम ब्रोमाइड का अवरक्त क्षेत्र में अर्थात 4000cm- 1 से 666cm-1 तक कोई अवशोषण बैण्ड प्राप्त नहीं होता है परन्तु न्यूजोल उच्च अणुभार वाले पैराफिनिक हाइड्रोकार्बन होने के कारण तीन अवशोषण बैण्ड अवरक्त क्षेत्र में देता है ।
अवरक्त स्पेक्ट्रम, पारगम्यता (Transmittance) अथवा अवशोषण की तीव्रता (intensity of absorption) एवं तरंग संख्या (cm – 1 ) के मध्य ग्राफ के रूप में प्राप्त होता है। इसमें ग्राफ के आधार पर तरंग संख्या (cm) के मानों को रखा जाता है जबकि Y-अक्ष पर पारगम्यता अथवा अवशोषण की तीव्रता को रखा जाता है। जैसे p-जाइलीन को अवरक्त स्पेक्ट्रा
अंगुली छाप क्षेत्र (Finger print region ) – अवरक्त स्पेक्ट्रोस्कोपी का सबसे महत्वपूर्ण उपयोग दो या अधिक यौगिकों के मिश्रण से उन सभी यौगिकों की अलग- अलग पहचान करना है। इस स्पेक्ट्रोस्कोपी के क्षेत्र में 1500cm’ से नीचे का क्षेत्र अंगुली छाप क्षेत्र कहलाता है । अंगुल छाप क्षेत्र में मुख्यतः समतलीयता (capillarity) परिवर्तित होती है जिसके लिए अत्यधिक ऊर्जा की आवश्कयता होती है। वह ऊर्जा इसी क्षेत्र से प्राप्त होती है, अवरक्त क्षेत्र से प्राप्त नहीं होती है। यही कारण है कि जो समूह अपने तनन कम्पनों में समतलीयता परिवर्तित करते है, इसी क्षेत्र में पाये जाते हैं। इस क्षेत्र के द्वारा दो ऐसे यौगिकों की पहचान भी की जा सकती है जिनके लिये 1500cm- 1 से अधिक वाले क्षेत्र में समान स्पेक्ट्रम प्राप्त होता है। कुछ क्रियात्मक समूह जैसे C-O, C-N, C-C, के तनन कम्पनों के अतिरिक्त बंकन कम्पनों के कारण भी अवशोषण बैंड प्राप्त होते हैं, वे भी इसी क्षेत्र में प्राप्त होते हैं। इस क्षेत्र में तनन कम्पनों की अपेक्षा बंकन कम्पनों की संख्या अधिक होती है।
अगुंली छाप क्षेत्र को तीन उपभागों में बांटा जा सकता है।
(i) 1500-1350 cm-1
(ii) 1350-1000 cm-1
(iii) 1000 cm-1 से नीचे
1500-1350 cm-1 का क्षेत्र – तरंग संख्या 1380 cm-1 तथा 1365cm-1 के आस-पास द्विक (doublet) की उपस्थिति उस यौगिक में तृतीयक ब्यूटिल समूह की उपस्थिति दर्शाता है जबकि नाइट्रो समूह के लिये प्राप्त दो प्रबल बैंडों में से एक बैण्ड अंगुली छाप क्षेत्र में 1350 cm-1 के पास ही प्राप्त होता है।
(ii) 1350-1000cm-1 का क्षेत्र- ऐल्कोहॉल, एस्टर, लेक्टोन तथा अम्ल ऐन्हाइड्राइड सभी इस क्षेत्र में C-O तनन के कारण अभिलाक्षणिक बैण्ड प्रदर्शित करते हैं। उदाहरणार्थ, प्राथमिक ऐल्कोहॉल में दो बैण्ड 1350-1260 cm तथा 1050cm – 1 के आस पास प्रदर्शित होते हैं। 1150-1070cm-1 के मध्य अवशोषण एस्टर समूह का अभिलाक्षणिक गुण है
(iii) 1000cm’ से नीचे का क्षेत्र – इस क्षेत्र में बंकन के कारण – 700cm-1 तथा 970–960cm-1 पर अवशोषण समपक्ष तथा विपक्ष रूपों को विभाजित करता है। इस क्षेत्र के द्वारा बेन्जीन में एकल प्रतिस्थापन तथा o, m एवं p स्थितियों पर द्विप्रतिस्थापन के लाक्षणिक अवशोषण बैंड की इस क्षेत्र में प्राप्त होते हैं। 750-700cm – 1 पर अवशोषण बैंड बेन्जीन पर एकल प्रतिस्थापन प्रदर्शित करता है।
कार्बनिक रसायन में कुछ प्रमुख वर्गों के अभिलाक्षणिक अवशोषण बैण्ड (Characteristic absorption bands of some important classes of organic chemistry) –
कार्बनिक यौगिकों के अवरक्त स्पेक्ट्रम की व्याख्या निम्न प्रकार की जा सकती है।
(1) ऐल्कोहॉल (ROH) – संतृप्त ऐल्कोहॉल में चार प्रकार के बन्ध होते हैं
C–C, C–H, C–O एवं O-H | इनमें दो प्रमुख अवशोषण बैण्ड है।
(i) O-H तनन कम्पन (O-H stretching vibrations) – इस तनन कम्पन की स्थिति एवं तीव्रता हाइड्रोजन बन्ध पर निर्भर करती है। ऐल्कोहॉल की गैसीय अथवा तनु विलयन अवस्था में हाइड्रोजन बन्ध की सम्भावना क्षीण होती है अतः – OH समूह मुक्त अवस्था में मिलता है। इस अवस्था में तीक्ष्ण अवशोषण बैण्ड 3650-3584 cm -1 पर प्राप्त होता है । ऐल्कोहॉल द्रव अथवा सान्द्र विलयन अवस्था में
हाइड्रोजन बन्धन के द्वारा संगुणित हो जाते हैं जिसके कारण अवशोषण बैण्ड कम तरंग संख्या क्षेत्र (3584–3200cm−1) पर प्रदर्शित होता है। बैण्ड की चौड़ाई तथा निम्नतर तरंग संख्या की ओर विस्थापन हाइड्रोजन बन्ध की मात्रा पर निर्भर करता है।
(ii) C–0 तनन कम्पन (C-Ostretching vibrations)- ऐल्कोहॉल तथा फीनॉल में C-O तनन कम्पन के कारण 1260–1000 cm-1 क्षेत्र में तीव्र अवशोषण बैण्ड प्राप्त होता है। C-O तनन कम्पन समीप के C–C तनन कम्पनों के साथ युग्मन करते हैं फलस्वरूप ऐल्कोहॉलों की प्रकृति अवशोषण बैण्ड को प्रभावित करती है। प्राथमिक ऐल्कोहॉल के लिए 1075-1000 cm-1 तक, द्वितीयक ऐल्कोहॉल के लिए 1150–1075cm-‘ तथा तृतीयक ऐल्कोहॉल के लिए 1210-100cm-1 तथा अवशोषण बैण्ड प्राप्त होता है।
इसके अतिरिक्त C-C तनन कम्पनों का अवशोषण 1500-1600 cm-1 क्षेत्र में मिलता है। C-H तनन कम्पन का मान कार्बन परमाणु के संकरण के प्रकार पर निर्भर करता है। C (sp 3 ) – Hबन्धों का कम्पन अवशोषण बैंड 2800-3000cm – 1. C (sp2) H बंधों के तनन कम्पन अवशोषण बैण्ड 3300cm -1 पर प्राप्त होते हैं। C-H बन्ध के बंकन कम्पन अपेक्षाकृत कम तरंग संख्या वाले क्षेत्र में लगभग 1430– 1470cm-1 पर प्रदर्शित होते है।
असंतृप्तता एवं ऐरोमैटिक वलय की उपस्थिति के करण C = C बन्ध का अवशोषण बैण्ड 1650 cm-1 पर प्राप्त होता है ।
चित्र 1.16 में 2-ब्यूटेनॉल का अवरक्त स्पेक्ट्रम प्रदर्शित किया गया है।
इसमें हाइड्रोजन बंध के कारण O-H तनन कम्पन अवशोषण बैंड 3300cm – 1 पर प्रदर्शित होता है। C—O तनन कम्पन्न अवशोषण बैंड 1100 cm – 1 पर है जो एक द्वितीयक ऐल्कोहॉल को इंगित करता है। सभी C-परमाणु sp3 संकरित अवस्था में है जिसके कारण C (sp 3 ) – H तनन कम्पन अवशोषण बैंड 2800-2950 cm-1 के मध्य है।
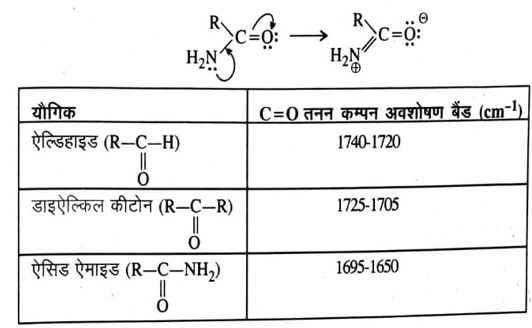
(2) C = O समूह युक्त यौगिक (Compounds containing C= O group ) – C = O समूह युक्त यौगिकों जैसे ऐल्डिहाइड, कीटोन, कार्बोक्सिलिक अम्ल, ऐसिड हैलाहड, ऐसिडऐनहाइड्राइड एवं ऐसिडऐमाइड आदि C=O तनन कम्पन के कारण 1870-1550 cm – 1 क्षेत्र में अवशोषण बैंड प्रदर्शित करते हैं। C=O तनन कम्पन अवशोषण बैंड की स्थिति विभिन्न यौगिकों में भिन्न-भिन्न होती है। इस बैंड की की स्थिति निम्नलिखित कारकों पर निर्भर करती हैं।
(i) संलग्न परमाणुओं या समूहों का प्रभाव – ऐलिफैटिक ऐल्डिहाइड में C = O तनन कम्पन के कारण अवशोषण बैंड 1740-1720 cm-1 क्षेत्र में आता है जबकि डाइ – ऐल्किल कीटोन में यह अवशोषण बैंड 1725-1705 cm-1 क्षेत्र में प्रदर्शित होता है।
डाइऐल्किल कीटोन के एक ऐल्किल समूह को यदि एक ऐसे समूह के द्वारा प्रतिस्थापित कर दे जो इलेक्ट्रॉन युग्म दाता हो तो अनुनाद प्रभाव (+M) के कारण कार्बोनिल समूह C= O की द्विबंध प्रकृति में कमी आ जाती है और अवशोषण बैंड निम्नतर तरंग संख्या की ओर विस्थापित हो जाता है। उदाहरणार्थ – ऐसिड ऐमाइड में ऐसा होता है।
यदि यौगिक X>c=0 में X एक – I प्रभाव वाला समूह (X= – OH, –OR, F, Cl, Br, I आदि) जुड़ा हो तो C= O बंध में द्विबंध प्रकृति बढ़ जाती है।
X= –OH, –OR, F, Cl, Br या I आदि ।
C=O में द्विबन्ध प्रकृति बढ़ने पर अवशोषण अपेक्षाकृत उच्चतर तरंग संख्या की ओर विस्थपित हो जाता है। उदाहरणार्थ- अम्ल, ऐस्टर, और एसिड हैलाइडों में C = O तनन कम्पन अवशोषण ऐल्डिहाइड एवं कीटोन की अपेक्षा उच्चतर तरंग संख्या पर होता है। निम्नलिखित सारणी में C = O में X के स्थान पर विभिन्न समूह जुड़ने पर उनके तनन कम्पन के कारण अवशोषण बैंड क्षेत्र को दर्शाया गया है—
(ii) संयुग्मन प्रभाव (Conjaction effect) कार्बोनिल समूह C = 0 के संयुग्मन में यदि C=C बन्ध उपस्थित है तो ग-इलेक्ट्रॉनों के विस्थानीकरण के परिणामस्वरूप C= O का ऑक्सीजन ऋणावेशित हो जाता है तथा अवशोषण बैण्ड कम तरंग संख्या की ओर विस्थापित हो जाता है। संयुग्मन की मात्रा जितनी अधिक होती है अवशोषण उतनी ही कम तरंगसंख्या पर होता है। एक ओलिफिनिक बन्ध के संयुग्मन के कारण अवशोषण 1685-1666 cm-1 क्षेत्र में होता है।
(iii) C=O समूह से संलग्न हाइड्रोजन बन्ध का प्रभाव- C = O समूह से हाइड्रोजन बंध संलग्न होने पर उसकी द्विबन्ध प्रकृति में कमी आ जाती है जिससे C = O तनन कम्पन के कारण अवशोषण निम्नतर तरंग संख्या की ओर होता है। उदाहरणार्थ- द्रव 2-ब्यूटेनॉन (CH3 – C –CH2CH3) (हाइड्रोजन
बंध की अनुपस्थिति) में C = O तनन कम्पन अवशोषण बैंड 1715 cm – 1 पर तथा इसके 1% मेथेनॉल में विलयन (अन्तरा अणुक हाइड्रोजन बंध की उपस्थिति होने के कारण ) में C = O तनन कंम्पन अवशोषण बैंड 1706 cm-1 पर प्रदर्शित होता है।
C=O समूह के अन्तःअणुक हाइड्रोजन बंध में प्रयुक्त होने पर अवशोषण बैंड की आकृति एवं तरंग संख्या क्षेत्र बहुत अधिक प्रभावित होते हैं। उदाहरणार्थ – B – डाइकीटोन के इनॉलिक रूप में हाइड्रोजन बंध निम्नलिखित अनुनादी संरचनाओं द्वारा स्थायी हो जाता है। इसी कारण से B-डाइकीटोन में तीव्र एवं चौड़ा अवशोषण बैंड 1640 से 1580 cm – 1 क्षेत्र में प्राप्त होता है।
(iv) वलय तनाव- विवृत श्रृंखला कीटोनों तथा छः सदस्यीय चक्रीय कीटोन में c >c = 0 कोण
लगभग 120° का होने के कारण यह तनाव मुक्त होता है जिससे C = 0 तनन कम्पन तरंग संख्या सामान्य कीटोन के अनुरूप ही होती है। वलय का आकार घटने पर इस कोण के छोटा होने के कारण उसमें तनाव उत्पन्न हो जाता है और तनन कम्पन उच्चतर तरंगसंख्या की ओर चला जाता है। उदाहरणार्थ-
(a) ऐल्डिहाइड (R- C – H) का अवरक्त स्पेक्ट्रम इसमें निम्न प्रकार के तनन कम्पन प्रमुख हैं-
(i) C = 0 तनन कम्पन- जैसा कि ऊपर बताया कि संतप्त ऐलिफैटिक एल्डिहाइड में C = 0 तनन कम्पन के कारण तीव्र अवशोषण बैंड 1740-1720 cm 1 क्षेत्र में प्रदर्शित होता है परन्तु संयुग्मन में C =C_ बंध होने पर या ऐरोमैटिक ऐल्डिहाइड में यह अवशोषण बैंड 1715-1695 cm – 1 क्षेत्र में विस्थापित हो जाता
है ।
(ii) C—H तनन कम्पन- ऐल्डिहाइड – C – H में CH बंध की उपस्थिति के कारण C—H तनन कम्पन होते हैं। अधिकांश ऐल्डिहाइड 2830-2695 cm 1 क्षेत्र में पर्याप्त तीव्रता वाले दो अवशोषण बैंड द्विक (doublet) प्रदर्शित करते हैं।
उदाहरणार्थ- नीचे प्रोपेनैल CH3CH2CHO का IR स्पेक्ट्रम दिया गया है।
प्रोपेनैल का IR स्पेक्ट्रम-
(i) C=0 तनन कम्पन के कारण तीव्र अवशोषण बैंड़ आवृत्ति 1720 cm-1
(ii) ऐल्डिहाइड का अभिलाक्षणिक C—H द्विक (doublet) 2820 cm-1 एवं 2715 cm-1 पर है।
(2) कीटोन (R- C – R) का अवरक्त स्पेक्ट्रम
(ii) C=0 तनन कम्पन अवशोषण बैंड जैसा ऊपर बताया गया है डाईऐल्किल कीटोन में C=0 तनन कम्पन के कारण तीव्र अवशोषण बैंड 1725-1705 cm-1 क्षेत्र में प्रदर्शित होता है। ऐरिल कीटोन में यह अवशोषण 1700-1680 cm -1 पर होता है।
तनन तथा बंकन कम्पन- ऐलिफैटिक डाइऐल्किल कीटोन में
nके कारण
बंकन कम्पन होता है। इन कम्पनों के कारण एक पर्याप्त तीव्रता युक्तं अवशोषण बैंड 1300-1100 cm-1 क्षेत्र में प्रदर्शित होता है। ऐरोमैटिक कीटोन में यह अवशोषण उच्च आवृत्ति पर होता है
उदाहरण-
(अ) ऐसीटोन (CH3—C—CH3) का IR स्पेक्ट्रम
(i) C=0 तनन कम्पन के कारण तीव्र अवशोषण बैंड आवृत्ति 1705 cm-1
(ii) C–C –C तनन तथा बंकन कम्पन के कारण तीव्र अवशोषण बैंड आवृत्ति 1210 cm-1
(ब) द्रव 2-ब्यूटेनॉन (CH3 – CH2 – C – CH3 ) का IR स्पेक्ट्रम
(i) C=0 तनन कम्पन के कारण पर्याप्त तीव्रता युक्त अवशोषण बैंड की आवृत्ति 1715 cm – 1
(ii) C–C –C तनन तथा बंकन कम्पन के कारण तीव्र अवशोषण बैण्ड आवृत्ति 1190 cm-1
(i) C=0 समूह के संयुग्मी C=C होने के कारण अर्थात् C=० समूह से ऐरोमैटिक वलय से जुड़ने के कारण C=C तनन कम्पन अवशोषण अपेक्षाकृत निम्नतर तरंग संख्या 1683 cm-1 पर होता है।
(ii) ऐरोमैटिक कीटोन में तनन तथा बंकन कम्पन के कारण अवशोषण अपेक्षाकृत उच्चतर तरंग संख्या 1260 cm-1 पर होता है ।
कार्बोक्सिलिक अम्लों में मुख्यतः निम्नलिखित तीन प्रकार के कम्पनों के कारण अवशोषण बैण्ड प्राप्त होते हैं।
(i) O—H तनन कम्पन (O – H stretching vibrations)- कार्बोक्सिलिक अम्ल गैसीय अथवा तनु विलयन अवस्था में एकलक (Monomer) रूप में रहते हैं। इस स्थिति में OH तनन कम्पन के कारण 3580-3500 cm-1 क्षेत्र में कम तीव्रता का अवशोषण बैण्ड प्रदर्शित होता है। ठोस, द्रव, अथवा सान्द्र विलयन अवस्था में कार्बोक्सिलिक अम्ल दो अणु हाइड्रोजन बन्धन के द्वारा परस्पर जुड़कर द्विलक बनाते है। यह द्विलक निम्न अनुनादी संरचनाओं द्वारा स्थायी रहता है।
इसमें मुक्त OH समूह का अभाव है। परिणामस्वरूप O – H तनन कम्पन के कारण एक चौड़ा बैण्ड 3300-2500 cm-1 क्षेत्र में प्रदर्शित होता है।
(ii) C=0 तनन कम्पन ( C = O stretching vibrations)- कार्बोक्सिलिक अम्ल एकलुक अवस्था में C=O तनन कम्पन के कारण 1760 cm 1 पर एक तीव्र अवशोषण बैण्ड प्रदर्शित करते हैं परन्तु द्विलक अवस्था में यह अवशोषण बैण्ड 1720-1706 cm – 1 क्षेत्र में प्राप्त होता है । यदि कार्बोक्सिलिक अम्ल में अन्तः अणुक हाइड्रोजन बन्ध उपस्थित हो तो अवशोषण बैण्ड और भी कम तरंग संख्या की तरफ पर प्राप्त विस्थापित हो जाता है। उदाहरणार्थ- सैलिसिलिक अम्ल में यह अवशोषण बैण्ड 1665 cm – 1 होता है। इसी प्रकार C=O समूह के संयुग्मन में यदि C = C द्विबन्ध उपस्थित हो तब भी अवशोषण बैण्ड कम तरंग संख्या क्षेत्र में विस्थापित हो जाता है। a, B- असंतृप्त अम्लों में यह 1706-1680 cm – पर प्राप्त होता है।
(iii) C–0 तनन तथा C-O-H बंकन कम्पन (C – O stretching and C – O – H bending vibrations)- कार्बोक्सिलिक अम्लों में C-O तनन एवं C-O-H बंकन कम्पन के परिणामस्वरूप क्रमशः 1320-1210 cm-1 तथा 1440-1395 cm-1 क्षेत्र में तीव्र अवशोषण बैण्ड प्राप्त होते हैं। इसके अतिरिक्त तल के बाहर O—H समूह के बंकन के कारण भी एक चौड़ा, मध्यम तीव्रता का अवशोषण बैण्ड 960- 875 cm 1 क्षेत्र में प्राप्त होता है
नीचे प्रोपेनोइक अम्ल का अवरक्त स्पेक्ट्रम दिया जा रहा है। इसमें प्रमुख अवशोषण निम्नलिखित क्षेत्र में हैं-
(a) O – H तनन कम्पन के कारण चौड़ा अवशोषण बैंड 3500-2500 cm-1 पर,
(b) C=0 तनन कम्पन के कारण तीव्र अवशोषण बैंड 1700 cm – 1 पर,
(c) C–0 तनन कम्पन अवशोषण बैंड 1220 cm-1 पर,
(d) OH बंकन कम्पन अवशोषण 920 cm-1 पर
प्राथमिक ऐमाइडों में निम्नलिखित कम्पनों के कारण अवशोषण बैण्ड प्राप्त होते हैं-
(i) N—H तनन कम्पन (NH stretching vibrations)- ठोस अवस्था में ऐमाइडों में असममित एवं सममित तनन कम्पनों के परिणामस्वरूप क्रमश: 3350 cm-1 एवं 3180 cm-1 पर दो अवशोषण बैण्ड प्राप्त होते हैं।
(ii) C= O तनन कम्पन अथवा ऐमाइड – I बैण्ड (CO stretching vibrations of amide-I band)- ठोस अवस्था में ऐमाइडों में C = O तनन कम्पनों के कारण तीव्र अवशोषण बैण्ड 1695 -1630 cm-1 क्षेत्र में मिलता है। यह बैण्ड ऐमाइड – I बैण्ड भी कहलाता है ऐमाइड की विलयन अवस्था में यह बैण्ड उच्च तरंगसंख्या क्षेत्र की ओर विस्थापित हो जाता है। इसका कारण यह है कि तनुकरण करने पर CO समूह की NH, समूह के साथ अन्तराणविक हाइड्रोजन बन्ध की मात्रा घटती जाती है।
(iii) N—H बंकन कम्पन अथवा ऐमाइड – II बैण्ड ( N – H bending vibrations of amide – II # band) ठोस अवस्था में NH बंकन कम्पनों के परिणामस्वरूप अवशोषण बैण्ड 1655-1620 cm-1 क्षेत्र में प्राप्त होता है। इसे ऐमाइड – II बैण्ड भी कहते हैं विलयन का तनुकरण करने पर यह अवशोषण बैण्ड कम तरंग संख्या (1620-1590 cm – 1 ) की ओर विस्थापित हो जाता है।
(iv) अन्य कम्पन बैण्ड (Other vibration bands ) – ऐमाइडों में उपर्युक्त अवशोषण के अतिरिक्त C—N तनन के कारण 1400 cm-1 के निकट एक अवशोषण बैण्ड प्राप्त होता है। NH समूह के संदोलन (rocking) के कारण एक चौड़ा बैण्ड 750-600 cm-1 क्षेत्र में NH समूह के अभिदोलन (Wagging) के कारण 800-666cm-1 में एक चौड़ा बैण्ड प्राप्त होता है।
नीचे बेंज़ैमाइड का अवरक्त स्पेक्ट्रम दिया जा रहा है।
(i) NH तनन कम्पन अवशोषण बैंड (सममित एवं असममित कम्पनों का युग्मन ) 3500-3300 cm-1
(ii) C = O तनन कम्पन अवशोषण बैण्ड 1659 cm-1 पर
(iii) NH बंकन कम्पन बैण्ड 1626 cm-1 पर
(iv) C – N तनन कम्पन बैण्ड 1403 cm-1 पर
(5) एस्टर (Ester)का अवरक्त स्पेक्ट्रम
एस्टर में समूह होता है। जिसके अवरक्त स्पेक्ट्रम में मुख्य रूप से दो तनन कम्पन C = O तथा CO होते हैं।
(i) C=0 तनन कम्पन ( C = D. stretching vibration)- संतृप्त ऐलिफैटिक एस्टर 1750-1735 cm-1 क्षेत्र में एक तीव्र अवशोषण बैण्ड प्रदर्शित करते हैं। फार्मेट, a, B असंतृप्त तथा ऐरोमैटिक एस्टर का यह अवशोषण बैण्ड कम तरंग संख्या क्षेत्र की ओर (1730-1715 cm – 1) पर प्राप्त होता है. परन्तु a हैलोजन एस्टर में यह उच्च तरंग संख्या क्षेत्र (1770 cm-1) में मिलता है।
(ii) C– 0 तनन कम्पन (C-O stretching vibrations) C – 0 तनन कम्पन के कारण एस्टरों के अवरक्त स्पेक्ट्रम में 1300-1000 cm – 1 क्षेत्र में एक युग्मित अवशोषण बैण्ड प्राप्त होता है। यह बैण्ड तथा O–C–C तनन कम्पनों के युग्मन के कारण होता है। संतृप्त एस्टरों में यह अवशोषण बैण्ड 1240 cm – पर जबकि असंतृप्त एस्टरों में यह बैण्ड 1190-1140 cm-1 क्षेत्र में प्राप्त होता है।
एथिलऐसीटेट का अवरक्त स्पेक्ट्रम निम्न प्रकार है-
(6) ऐमीन (Amines) का अवरक्त स्पेक्ट्रम
ऐमीनो यौगिकों में निम्नलिखित तीन प्रकार के कम्पनों के परिणामस्वरूप अवरक्त स्पेक्ट्रम में अवशोषण बैण्ड प्रदर्शित होते हैं।
(i) N—H तनन कम्पन (N—H streching vibrations) – प्राथमिक ऐमीनों के तनु विलयनों के अवरक्त स्पेक्ट्रम में NH बन्ध के सममित एवं असममित तनन कम्पनों के कारण क्रमशः 3500- cm-1 तथा 3400 cm-1 पर दो दुर्बल अवशोषण बैण्ड प्राप्त होते हैं। हाइड्रोजन बन्धन के कारण ये अवशोषण बैण्ड कम तरंग संख्या क्षेत्र की ओर विस्थापित हो जाते हैं। ऐरोमैटिक ऐमीनों में यह अवशोषण बैण्ड अनुनाद के कारण उच्च तरंग संख्या क्षेत्र की ओर विस्थापित हो जाते हैं।
(ii) N—H बंकन कम्पन (NH bending vibrations) – प्राथमिक ऐमीन के अवरक्त स्पेक्ट्रम में N—H बंकन कम्पन अर्थात कर्तरीकरण (scissoring) के कारण 1650-1580 cm-1 पर एक मध्यम तीव्रता का अवशोषण बैण्ड प्राप्त होता है। द्वितीयक ऐमीन कर्तरीकरण के कारण बैण्ड प्रदर्शित नहीं करते परन्तु अभिदोलन कम्पन के परिणामस्वरूप 909-666 cm – 1 पर एक तीक्ष्ण अवशोषण बैण्ड प्रदर्शित करते हैं। NH बंकन कम्पन की वास्तविक स्थिति हाइड्रोजन बन्ध की मात्रा पर निर्भर करती है।
(iii) C—N तनन कम्पन (C—N stretching vibrations)- C – N तनन कम्पन के कारण ऐलिफैटिक ऐमीन 1250-1020 cm 1 क्षेत्र के मध्यम से क्षीण तीव्रता का अवशोषण बैण्ड प्रदर्शित करते हैं। ऐरोमैटिक ऐमीनो में यह अवशोषण उच्च तरंग संख्या वाले क्षेत्र ( 1342-1266 cm 1 ) की ओर विस्थापित हो जाता है। इस बैण्ड की वास्तविक स्थिति ऐमीनो के कार्बन परमाणु की प्रकृति पर निर्भर करती है। – आइसोब्यूटिल ऐमीन का अवरक्त स्पेक्ट्रम निम्न प्रकार प्राप्त होता है।
(7) ईथर का अवरक्त स्पेक्ट्रम
ईथर में C-O-C समूह होता है। अतः अवरक्त स्पेक्ट्रम में मुख्य रूप से अवशोषण बैण्ड C- O-C तनन कम्पनों के कारण प्राप्त होता है ।
C—O—C तनन कम्पन (C – O – C streching vibration)- ऐलिफैटिक ईथर में C-O-C असममित तनन कम्पन के कारण 1150-1085 cm – 1 पर एक अभिलाक्षणिक तीव्र अवशोषण बैण्ड प्राप्त होता है। यदि ऑक्सीजन परमाणु से जुड़े कार्बन परमाणु पर श्रृंखलन (branching) हो तो यह C—O— C अवशोषण बैण्ड विभाजित (splitted) हो जाता है।
उदाहरणार्थ— डाइआइसोप्रोपिल ईथर के अवरक्त स्पेक्ट्रम में 1170-1114 cm – 1 क्षेत्र में एक त्रिक = बैण्ड (Tripplet band) प्राप्त होता है। वाइनिल तथा ऐरिल ईथर में यह अवशोषण बैण्ड उच्च तरंग संख्या
वाले क्षेत्र की ओर विस्थापित हो जाता है तथा क्रमशः 1225-1200 cm-1 एवं 1275-1200 cm-1 पर प्राप्त होता है। अवशोषण बैण्ड में यह विस्थापन अनुनाद के कारण होता है जिसके परिणामस्वरूप C–O बन्ध सामर्थ्य बढ़ जाती है।
C—O—C सममित तनन कम्पन 1075-1020 cm-1 क्षेत्र में अवशोषण बैण्ड प्रदर्शित करते हैं। डाइ n-प्रोपिल ईथर का अवरक्त स्पेक्ट्रम चित्र 1.25 में दिया गया है। इसमें C–०–C तनन बैण्ड कम्पन के कारण तीव्र अवशोषण बैण्ड 1100 cm – 1 पर प्राप्त होता है।
इस क्षेत्र में स्पेक्ट्रम, अणु के बाह्य आण्विक कक्षकों में उपस्थित इलेक्ट्रॉनों के उच्च ऊर्जा आण्विक कक्षकों में संक्रमण के कारण प्राप्त होते हैं ।
8. ऐरोमैटिक हाइड्रोकार्बन :- बैंजीन एवं उसमें सजात् C-C तनन कम्पन के कारण 1600-1450 cm-‘ पर अवशोषण बैण्ड प्रदर्शित करते है । इसके अतिरिक्त Ar – H बन्ध के तनन कम्पन के कारण 3050 – 3000 cm-‘ पर तथा Ar-H बन्ध में बंकन कम्पन के कारण 700-900 cm-1 पर अवशोषण बैण्ड प्राप्त होते हैं।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics