मैलिक अम्ल क्या है किसमें पाया जाता है उपयोग malic acid in hindi use structure definition
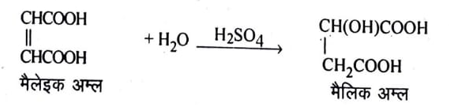
malic acid in hindi use structure definition मैलिक अम्ल क्या है किसमें पाया जाता है उपयोग किसे कहते हैं संरचना लिखिए |
मैलिक अम्ल (मोनोहाइड्रॉक्सी सक्सिनिक अम्ल) CH(OH) COOH
||
CH2COOH
सर्वप्रथम शीले (Scheele) ने सन् 1785 में मैलिक अम्ल को कच्चे सेवों से प्राप्त किया था (लेटिन 10 भाषा में malum = Apple सेव) । मैलिक अम्ल अन्य फलों जैसे खट्टे अंगूर, कच्चे बेर आदि तथा सरस अ फलों (barrires) में भी पाया जाता है।
बनाने की विधियाँ-
(1) ऐश बेरीज से (From ash barries )- कच्चे ऐश- बेरीज को उबलते हुए जल से निष्कर्षित करते मा | निष्कर्षण को दूधिया चूनें (milk of lime ) के साथ अभिक्रिया कराते हैं जिससे अल्प विलेय कैल्सियम मैलेट अवक्षेपित हो जाता है। इसे छानकर अलग कर लेते हैं और इसकी तनु सल्फ्यूरिक अम्ल की परिकलित मात्रा के साथ अभिक्रिया पर मैलिक अम्ल बनता है। कैल्सियम सल्फेट का अवक्षेप भी बनता है जिसे छान कर अलग कर देते हैं।
(2) मैलेइक अम्ल को उच्च दाब पर तनु H2SO4 के साथ गर्म करके मैलिक अम्ल का संश्लेषण किया जाता है।
(3) प्रयोगशाला में मैलिक अम्ल को ब्रोमोसक्सिनिक अम्ल की नम सिल्वर ऑक्साइड के साथ अभिक्रिया द्वारा बनाया जाता है।
(4) मैलिक अम्ल को ऐस्पार्टिक अम्ल पर नाइट्रस अम्ल की अभिक्रिया से बनाते हैं।
(5) टार्टरिक अम्ल के HI द्वारा आंशिक अपचयन से भी मैलिक अम्ल बनता है।
समावयवता— मैलिक अम्ल में एक असममित कार्बन परमाणु उपस्थित होने के कारण यह प्रकाशिक समावयवता प्रदर्शित करता है। इसके तीन समावयवी रूप होते है ।। d मेलिक अम्ल, 1- मेलिक अम्ल तथा dl-मैलिक अम्ल| d–तथा / मैलिक अम्ल प्रकाश ध्रुवण घूर्णक है और एक-दूसरे के दर्पण प्रतिबिम्ब हैं जबकि रेसिमिक या dl–मैलिक अम्ल प्रकाश अध्रुवण घूर्णक है | dl-मैलिक अम्ल में d तथा 1 – मैलिक अम्ल की तुल्य मात्रायें उपस्थित होती है।
भौतिक गुण– मैलिक अम्ल रंगहीन क्रिस्टलीय ठोस है। इसके तीन रूप dमैलिक अम्ल (गलनांक 100°C.) /-मैलिक अम्ल (गलनांक 100°C.) तथा all-मैलिक अम्ल (गलनांक 135°C.) । – तथा / मैलिक अम्ल आर्द्रताग्राही होते हैं जबकि dl-मैलिक अम्ल आर्द्रताग्राही नहीं होता। ये जल तथा ऐल्कोहॉल में विलेय है और ईथर में कम विलेय है।
रासायनिक अभिक्रियायें – मैलिक अम्ल एक द्वितीयक ऐल्कोहॉल तथा डाइकार्बोक्सिलिक अम्ल की क भांति व्यवहार करता है। इसकी कुछ अभिक्रियायें निम्न प्रकार है-
(1) ताप का प्रभाव- मैलिक अम्ल को 160°- 180°C पर गर्म करने पर मैलेइक ऐनहाइड्राइड तथा फ्यूरिक अम्ल का मिश्रण प्राप्त होता है।
(2) अपचयन – मैलिक अम्ल का सांद्र HI से अपचयन करने पर सक्सिनिक अम्ल बनता
(3) ऑक्सीकरण – मैलिक अम्ल का अम्लीय पोटैशियम परमैंगनेट अथवा फेंटन अभिकर्मक + H2O2) के द्वारा सावधानीपूर्वक ऑक्सीकरण करने पर ऑक्सेलोऐसीटिक अम्ल बनता है।
CH(OH)COOH
क्रोमिक अम्ल से ऑक्सीकरण करने पर यह मैलोनिक अम्ल में परिवर्तित हो जाता है।
उपयोग— (i) मैलिक अम्ल को सिट्रिक अम्ल के स्थान पर पेय पदार्थों तथा जेली आदि बनाने में प्रयुक्त किया जाता है ।
(ii) औषधि के रूप में गले के दर्द में प्रयुक्त होता है ।
टार्टरिक अम्ल में दो समान असममित कार्बन परमाणु होते हैं। अतः यह प्रकाशिक समावयवता प्रदर्शित करता है। इसके चार समावयवी d या (+) टार्टरिक अम्ल, 1-या (-) टार्टरिक अम्ल, मीसो-टार्टरिक अम्ल तथा dl- या (# ) – टार्टरिक अम्ल होते हैं। इनकी संरचनायें निम्न प्रकार हैं-
(* यह चिन्ह असममित कार्बन परमाणु को प्रदर्शित करता है)
d–तथा ।–टार्टरिक अम्ल प्रकाश ध्रुवण घूर्णक है और एक-दूसरे के दर्पण प्रतिबिम्ब होते हैं। मीसो- तथा dl-टार्टरिक अम्ल प्रकाश ध्रुवण अघूर्णक है। मीसो रूप में सममित तल (Plane of symmetry) होने कारण और dl-रूप में d तथा । – रूपों की तुल्य मात्रायें उपस्थित होने के कारण ये प्रकाश ध्रुवण अघूर्णक (Optically inactive) होते हैं ।।
दक्षिणावर्त (Dextro) या d-या (+)- टार्टरिक अम्ल – प्रकृति में मुख्य रूप से (+) टार्टरिक अम्ल ही पाया जाता है। यह इमली (Tamarind ), अंगूर (Grapes), आलुबुखारे (Plums) आदि में मुक्त अवस्था अथवा पोटैशियम टार्टरेट के रूप में उपस्थित होता है। शीले ने 1769 में (+) टार्टरिक अम्ल को आरगॉल (Argol) से प्राप्त किया था। आरगॉल एक लाल भूरे रंग का क्रिस्टलीस ठोस है जो अंगूर के रस का किण्वन करते समय उपजात के रूप में पृथक् होता है। आरगॉल का गर्म जल से क्रिस्टलीकरण करने पर एक सफेद रंग का क्रिस्टलीय ठोस पदार्थ प्राप्त होता है जिसे टार्टर का क्रीम (Cream of tartar) कहते हैं । यह अम्ल पोटैशियम टार्टरेट होता है।
आरगॉल (+) टार्टरिक अम्ल प्राप्त करना – आरगॉल को गर्म जल में घोलकर इसे कैल्सियम हाइड्रॉक्साइड द्वारा उदासीन करते हैं। कैल्सियम टार्टरेट का अवक्षेप बनता है और पोटैशियम टार्टरेट विलयन मे रह जाता है।
अवक्षेप को छान लेते हैं और छनित में कैल्सियम क्लोराइड का विलयन मिलाते हैं जिससे कैल्सियम टार्टरेट अपक्षेपित हो जाता है।
ऊपर दोनों पदों में प्राप्त कैल्सियम टार्टरेट को मिलाकर इसका परिकलित तनु H2SO4 से अपघटन करते हैं। बने कैल्सियम सल्फेट के अवक्षेप को छानकर अलग कर देते हैं। छनित को वाष्पन द्वारा सांद्रित करके क्रिस्टलीकरण करने पर निर्जल (+)- टार्टरिक अम्ल (गलनांक 170°C) के क्रिस्टल प्राप्त होते हैं।
वामावर्त या (–) टार्टरिक अम्ल – यह प्रकृति में नहीं पाया जाता। इसे रेसिमिक या dal – टार्टरिक अम्ल के वियोजन से प्राप्त करते हैं।
रेसिमिक या dl – या ()– टार्टरिक अम्ल तथा मीसो टार्टरिक अम्ल मीसो टार्टरिक अम्ल को निम्नलिखित विधियों द्वारा संश्लेषित किया जा सकता है-
(i) फ्यूमेरिक अम्ल का तनु क्षारकीय परमैंगनेट ऑक्सीकरण से (+)- टार्टरिक अम्ल प्राप्त होता है।
(ii) मैलेइक अम्ल का तनु क्षारकीय परमैंगनेट ऑक्सीकरण से मीसो – टार्टरिक अम्ल बनता है।
(iii) a, a’–डाइब्रोमोसक्सिनिक अम्ल को जल में निलंबित Ag2O के साथ गर्म करने पर दोनों dl- तथा मीसो – टार्टरिक अम्ल बनते हैं।
(iv) dl–तथा मीसो–टार्टरिक अम्ल को ग्लाइऑक्सेल सायनोहाइड्रिन के जल अपघटन से भी किया जाता है।
टार्टरिक अम्ल के भौतिक गुण- टार्टरिक अम्ल रंगहीन क्रिस्टलीय ठोस पदार्थ है। यह जल तथा ऐल्कोहॉल में विलेय है परन्तु ईथर में अविलेय है। टार्टरिक अम्ल विभिन्न रूपों के भौतिक गुण निम्न सारणी 6.3 में दिये गये हैं-
रासायनिक अभिक्रियायें (Chemical reactions )– टार्टरिक अम्ल के सभी रूपों की रासायनिक अभिक्रियायें समान होती हैं। यह दो द्वितीयक ऐल्कोहॉली समूहों तथा द्विकार्बोक्सिलिक अम्ल की अभिक्रियायें देता है।
(1) लवणों का बनना – टार्टरिक अम्ल क्षारों के साथ अभिक्रिया करके तीन प्रकार के लवण – अम्ल लवण, सामान्य लवण तथा मिश्रित लवण बनाता है।
(2) एस्टरों का बनना – टार्टरिक अम्ल ऐल्कोहॉल से अभिक्रिया करके दो प्रकार के एस्टर अम्ल एस्टर तथा सामान्य एस्टर बनाता है।
(3) अमोनिया के साथ – टार्टरिक अम्ल अमोनिया के साथ अभिक्रिया करके अमोनियम टार्टरेट बनाता है जो गर्म करने पर इसका ऐमाइड व्युत्पन्न देता है ।
(4) PCI5 के साथ— फॉस्फोरस पेंटाक्लोराइड के साथ अभिक्रिया करके यह डाइक्लोरो सक्सिनिल क्लोराइड बनाता है।
(5) हाइड्रोजन ब्रोमाइड के साथ- हाइड्रोजन ब्रोमाइड के साथ अभिक्रिया करके यह डाइब्रोमोसक्सिनिक अम्ल बनाता है।
(6) ऐसीटिलीकरण – ऐसीटिल क्लोराइड के साथ अभिक्रिया करने पर टार्टरिक अम्ल के मोनो ऐसीटिल तथा डाइऐसीटिल व्युत्पन्न प्राप्त होते हैं।
(7) सांद्र H2SO4 से – टार्टरिक अम्ल को सांद्र सल्फ्यूरिक अम्ल के साथ गर्म करने पर यह काला पड़ जाता है और कार्बनमोनॉक्साइड, कार्बनडाइऑक्साइड तथा सल्फरडाइऑक्साइड में अपघटित हो जाता है।
(8) ताप का प्रभाव – जब टार्टरिक अम्ल को इसके गलनांक से उच्च ताप पर गर्म किया जाता है तो यह एक जल का अणु त्याग कर ऐनहाइड्राइड बनाता है।
अधिक उच्च ताप पर गर्म करने पर यह काला पड़ जाता है और पाइरूविक अम्ल बनता है ।
(9) अपयचन- टार्टरिक अम्ल का सांद्र HI विलयन से अपचयन पर पहले यह मैलिक अम्ल में और बाद में सक्सिनिक अम्ल में परिवर्तित हो जाता है।
(10) ऑक्सीकरण –
(i) टॉलेन अभिकर्मक (अमोनिया युक्त सिल्वर नाइट्रेट) से ऑक्सीकरण करने पर टार्टोनिक अम्लH(OH)COOH
(ii) फेंटन अभिकर्मक (FeSO4 + H2O2) से ऑक्सीकरण करने पर यह डाइहाइड्रॉक्सी मैलेइक अम्ल बनाता है।
(iii) प्रबल ऑक्सीकारकों से ऑक्सीकरण पर ऑक्सेलिक अम्ल बनता है।
(11) जटिल का बनना – टार्टरिक अम्ल का सोडियम पोटैशियम लवण ( रोशैल लवण), फेलिंग विलयन बनाने में प्रयुक्त होता है। फेलिंग विलयन A कॉपर सल्फेट का जलीय विलयन होता है और फेलिंग विलयन B रोशैल लवण का सोडियम डाइड्रॉक्साइड में क्षारकीय विलयन होता है। दोनों विलयनों को बराबर मात्रा में मिलाने पर एक गहरे नीले रंग का विलयन प्राप्त होता है जिसमें कॉपर का संकुल लवण उपस्थित होता है। इस संकुल लवण की संरचना निम्न प्रकार होती है—
उपयोग – (i) फेन युक्त तथा नमकीन (Efferevescent and saline) पेय पदार्थ बनाने में।
(ii) बैकिग पाउडर बनाने में ।
(iii) एमेटिक टार्टर (Tartar emetic) या पोटैशियम ऐन्टिमोनिल टार्टरेट विष के उपचार में औषधि के रूप में।
(iv) फेलिंग विलयन बनाने में सोडियम पोटैशियम टार्टरेट का उपयोग किया जाता है।
(v) रंग बंधक के रूप में।
(vi) रंजत दर्पण बनाने में ।
संरचना– (i) टार्टरिक अम्ल का अणुसूत्र C4H6O6 है ।
(ii) टार्टरिक अम्ल दो प्रकार के लवण तथा एस्टर बनाता है। अतः इसमें दो कार्बोक्सिलिक समूह (−COOH) उपस्थित होने चाहिये। चूँकि यह गर्म करने पर CO2 नहीं त्यागता, अतः दोनों – COOH समूह दो भिन्न–भिन्न कार्बन परमाणुओं पर उपस्थित होने चाहिये ।
(iii) यह ऐसीटिल क्लोराइड के साथ अभिक्रिया करके डाइऐसीटिल व्युत्पन्न तथा PCI5 अभिक्रिया करके डाइक्लोरो व्युत्पन्न बनाता है अतः इसमें दो – OH समूह उपस्थित होने चाहिये। टार्टरिक अम्ल एक स्थायी यौगिक है। अतः दोनों – OH समूह दो भिन्न कार्बन परमाणुओं पर उपस्थित होने चाहियें। इसके अणुसूत्र तथा विभिन्न परमाणुओं की संयोजकतायें ध्यान में रखते हुए इसकी निम्नलिखित संरचना दी जा सकती है-
(iv) टार्टरिक अम्ल की संरचना को इसके पूर्ण संश्लेषण द्वारा निम्न प्रकार निश्चित किया जा सकता
6.14 सिट्रिक अम्ल या नींबू का अम्ल
सिट्रिक अम्ल बहुत से सिट्रिस समूह के खट्टे फलों जैसे नारंगी, गलगल, माल्टा, नींबू आदि में पाया जाता है। साधारणतया कच्चे फलों में इसकी मात्रा अधिक होती है। यह टमाटर में भी मिलता है। सिट्रिक अम्ल थोड़ी-सी मात्रा में दूध, पनीर तथा शराब आदि में भी उपस्थित होता है। नीबू के रस में सिट्रिक अम्ल लगभग 6–10% तक होता है।
बनाने की विधि-
(1) नीबू के रस से – नीबू के रस को उबाला जाता है जिससे कि उसमें उपस्थित प्रोटीनों का स्कंदन (Coagulation) हो जाता है। स्कंदित प्रोटीन को छानकर पृथक कर देते हैं। छनित को चूने के पानी या कैल्सियम कार्बोनेट के द्वारा उदासीन करने पर कैल्सियम सिट्रेट का अवक्षेप प्राप्त होता है। इसे छानकर अलग कर लेते हैं। इस कैल्सियम सिट्रेट के अवक्षेप को तनु सल्फ्यूरिक अम्ल की आकलित मात्रा से अपघटित करने पर कैल्सियम सल्फेट का अवक्षेप बनता है जिसे छान कर अलग कर देते हैं। छनित में सिट्रिक अम्ल होता है। छनित का सांद्रण करने पर सिट्रिक अम्ल मोनोहाइड्रेट के क्रिस्टल बनते हैं।
(2) शीरे से – शीरे, सुक्रोस या ग्लूकोस के 10-12 प्रतिशत विलयन का वायु की उपस्थिति में साइट्रोमाइसीज फिफेरियेनस (Citromyces pfefferianus) या ऐस्पर्जिलस वेटी (Aspergillus wenti) द्वारा किण्वन करने पर सिट्रिक अम्ल बनता है । विलयन की pH3 से 5 रखी जाती है। किण्वन 7 से 10 दिन में पूर्ण हो जाता है। इस विलयन से सिट्रिक अम्ल को Ca-लवण के रूप में अलग करके ऊपर बतायी विधि द्वारा सिट्रिक अम्ल में परिवर्तित कर लेते हैं।
(3) संश्लेषण से (By synthesis) (i) सिट्रिक अम्ल को ग्लिसरॉल से निम्न अभिक्रिया अनुक्रम द्वारा बनाया जा सकता है-
(ii) लॉरेन्स (1897) ने सिट्रिक अम्ल को रिफॉर्मेट्स्की अभिक्रिया का उपयोग करके निम्न प्रकार बनाया-
भौतिक गुण– सिट्रिक अम्ल जल के एक अणु के साथ क्रिस्टलीकृत हो जाता है। इसका गलनांक 101°C है। यह 130°C पर जल के अणु को त्याग देता है। निर्जल अम्ल का गलनांक 153°C है। यह जल तथा ऐल्कोहॉल में शीघ्रता से विलेय हो जाता है परन्तु ईथर में कठिनाई से घुलता है।
रासायनिक गुण – सिट्रिक अम्ल में तीन कार्बोक्सिलिक तथा एक ऐल्कोहॉलिक समूह है। अतः यह इन समूहों की अभिक्रियायें देता है। कुछ अभिक्रियायें निम्न प्रकार हैं-
(1) लवण का बनना – यह क्षारों के साथ तीन प्रकार के लवण बनाता है-
(2) एस्टरों का बनना (Ester formation)- सिट्रिक अम्ल, लवणों की भांति ही ऐल्कोहॉल के साथ तीन प्रकार के एस्टर बनाता है।
(3) ऐसीटिलीकरण– सिट्रिक अम्ल की ऐसीटिक ऐनहाइड्राइड के साथ अभिक्रिया से उसके ऐल्कोहॉलिक समूह का ऐसीटिलीकरण हो जाता है और मोनोऐसीटिल सिट्रिक अम्ल बनता है।
(4) HI के साथ अपचयन – HI के साथ गर्म करने पर इसके – OH समूह का अपचयन हो जाता
(5) ताप का प्रभाव – सिट्रिक अम्ल को 150°C पर गर्म करने पर यह जल का एक अणु त्याग देता है तथा एक असंतृप्त अम्ल ऐकोनिटिक अम्ल बनता है।
ऐकोनिटिक अम्ल को और उच्च ताप पर गर्म करने पर इसमें से CO2 निकल जाती है और तीन समावयवी अम्ल मीसेकोनिक अम्ल, सिट्रेकोनिक अम्ल तथा इटेकोनिक अम्ल बनते हैं।
(6) साद H2SO4 के साथ- सांद्र H2SO4 के साथ गर्म करने पर ऐकोनिटिक अम्ल तथा फ्यूमिंग सल्फ्यूरिक अम्ल के साथ गर्म करने पर ऐसीटोन डाइकार्बोक्सिलिक अम्ल बनते हैं।
(7) संकुल का बनाना (Complex formation)—- टार्टरिक अम्ल की भांति यह भी धात्विक हाइड्रॉक्साइडों के साथ विलेय संकुल बनाता है।
क्यूकि हाइड्रॉक्साइड के साथ पोटैशियम सिट्रेट निम्न संकुल बनाता है-
उपयोग–
(i) मिठाइयों तथा पेय पदार्थ के बनाने में ।
(ii) रंगाई तथा छपाई में ।
(iii) मैग्नीशियम साइट्रेट कब्ज की बीमारी को दूर करने में ।
(iv) ब्यूटिल साइट्रेट प्लास्टिक के विलायक के रूप में ।
(v) फैरिक अमोनियम साइट्रेट रक्त की कमी को दूर करने में ।
(vi) सोडियम साइट्रेट बच्चों के खाद्य पदार्थों में ।
(vii) बेनेडिक्ट विलयन बनाने में ।
संरचना–
(I) सिट्रिक अम्ल का अणुसूत्र C6H8O7 है ।
(2) यह तीन प्रकार के लवण तथा एस्टर बनाता है। अतः इसमें तीन –COOH समूह उपस्थित हैं।
(3) यह ऐसीटिक ऐनहाइड्राइड के साथ अभिक्रिया करके मोनोऐसीटिल सिट्रिक अम्ल बनाता है। अतः इसमें एक – OH समूह उपस्थित होना चाहिए ।
(4) सिट्रिक अम्ल को गर्म करने पर ऐकोनिटिक अम्ल बनता है। अतः – OH समूह एक –COOH समूह से p- स्थिति पर होना चाहिए ।
(5) उपर्युक्त गुणों तथा C – परमाणु की चतुसंयोजकता के आधार पर सिट्रिक अम्ल की निम्न दो संरचनायें संभव हैं-
(6) चूँकि सिट्रिक अम्ल सधूम सल्फ्यूरिक अम्ल के साथ गर्म करने पर ऐसीटोनडाइकार्बोक्सिलिक अम्ल बनाता है। अतः सिट्रिक अम्ल की संरचना II अधिक उपयुक्त है।
(7) सिट्रिक अम्ल का ग्लिसरॉल से संश्लेषण इसकी संरचना की पुष्टि करता है। (ग्लिसरॉल से संश्लेषण, बनाने की विधि में देखें)
डाइकार्बोक्सिलिक अम्ल (Dicarboxylic Acid)
ऐसे कार्बनिक यौगिक जिनमें दो कार्बोक्सिलिक समूह (-COOH) उपस्थित होते हैं, डाइकार्बोक्सिलिक अम्ल कहलाते हैं। डाइकार्बोक्सिलिक अम्ल संतृप्त और असंतृप्त दोनों प्रकार के होते हैं।
ऐलिफैटिक संतृप्त डाइकार्बोक्सिलिक अम्लों का सामान्य सूत्र CnH2n (COOH)2 या (CH2),(COOH)2 होता है। साधारणतया संतृप्त डाइकार्बोक्सिल अम्लों को उनके रूढ़ नाम (Trivial name) से ही जाना जाता है। IUPAC पद्धति में इन्हें ऐल्केन डाइओइक अम्ल कहते हैं। कुछ महत्वपूर्ण संतृप्त डाइकार्बोक्सिलिक अम्ल सारणी 6.4 में उनके रूढ़ तथा IUPAC नाम के साथ दिये गये हैं।
बनाने की सामान्य विधियाँ-
(1) डाइहाइड्रिक ऐल्कोहॉल या हाइड्रॉक्सी ऐल्डिहाइड या हाइड्रॉक्सी अम्ल या डाइऐल्डिहाइड या ऐल्डिहाइड अम्ल के ऑक्सीकरण से-
(2) डाइसायनाइडों या सायनों अम्लों के जल अपघटन से
डाइसायनाइड, डाइब्रोमो ऐल्केन पर पोटैशियम सायनाइड की अभिक्रिया से और सायनों अम्ल हैलोजन अम्लों पर पोटैशियम सायनाइड अभिक्रिया से बनाये जाते हैं।
(3) हैलोजन प्रतिस्थापी मोनों कार्बोक्सिलिक अम्ल एस्टरों की Zn या Ag के साथ अभिक्रिया से-
(4) असंतृप्त डाइकॉर्बोक्सिलिक अम्लों के अपचयन से-
(5) डाइकॉर्बोक्सिलिक अम्लों के पोटैशियम ऐल्किल एस्टरों का विद्युत अपघटन करने पर क्रम ब्राउन वाकर विधि (Crum Brown Walker Method)-
इसी प्रकार साइक्लो हैक्सेनॉन से ऐडिपिक अम्ल बनता है।
असंतृप्त मोनोकार्बोक्सिलिक अम्लों के ऑक्सीकरण से-
ऑक्सीकरण के रूप में प्रबल ऑक्सीकारक, जैसे- सांद्र HNO3, अम्लीय KMnO4 करते हैं।
(8) डाइहैलोऐल्केन के ग्रीन्यार अभिकर्मक की CO2 के साथ अभिक्रिया द्वारा-
डाइकार्बोक्सिलिक अम्लों पर ताप एवं निर्जलीकारक अभिकर्मक का प्रभाव (Effect of Heat and Dehydrating agents) – डाइकार्बोक्सिलिक अम्लों को गर्म करने पर बनने वाला उत्पाद दोनों कार्बोक्सिलिक समूहों की सापेक्ष स्थितियों पर निर्भर करता है।
(i) वे डाइकार्बोक्सिलिक अम्ल जिनमें दोनों – COOH समूह एक ही कार्बन परमाणु पर जुड़े होते हैं, गर्म करने पर कार्बनडाइऑक्साइड का एक अणु त्याग कर मोनो कार्बोक्सिलिक अम्ल बनाते हैं, जैसे ऑक्सेलिक अम्ल से फॉर्मिक अम्ल और मैलोनिक अम्ल से ऐसीटिक अम्ल बनता है।
(i) अन्य डाइकार्बोक्सलिक अम्ल ब्लांक नियम के अनुसार अपघटित होते है।
ब्लांक का नियम- इसके अनुसार एक डाइकार्बोक्सिलिक अम्ल को सीधे 300°C पर आसवन करने पर या ऐसीटिक ऐनहाइड्राइड के साथ 300°C पर आसवन करने पर चक्रीय ऐनहाइड्राइड अथवा चक्रीय कीटोन बनते हैं जो दोनों कार्बोक्सिलिक अम्लों की आपेक्षिक स्थितियों पर निर्भर करता है । 1, 4- तथा, 1,5- डाइकार्बोक्सिलिक अम्लों से चक्रीय ऐनहाइड्राइड और 1,6 – तथा 1, 7-डाइकार्बोक्सिलिक अम्लों से चक्रीय कीटोन बनते हैं ।
(अ) 1,4― तथा 1,5-डाइकार्बोक्सिलिक अम्ल अकेले गर्म करने पर या ऐसीटिक ऐनहाइड्राइड के साथ आसवित करने पर जल का एक अणु त्याग कर चक्रीय ऐनहाइड्राइड बनाते हैं ।
(ब) 1,6–अथवा 1,7–डाइकार्बोक्सिलिक अम्लों को ऐसटिक एनहाइड्राइड के साथ 300° से. पर गर्म करने पर चक्रीय कीटोन प्राप्त होते हैं।
साइक्लोपेंटेनॉन
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics