liquefaction of gases in hindi | द्रवण किसे कहते हैं , गैसों का द्रवण क्या है , शीतलन के सिद्धांत
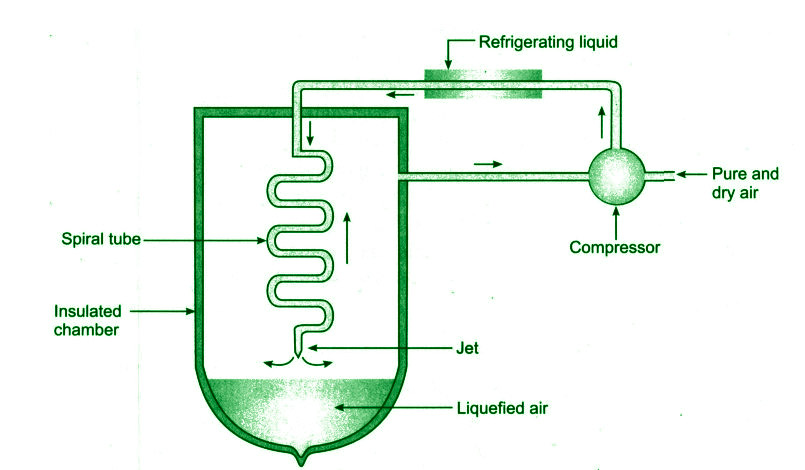
द्रवण किसे कहते हैं , गैसों का द्रवण क्या है , शीतलन के सिद्धांत liquefaction of gases in hindi किस गैस का द्रवण आसानी से होता है ?
गैसों का द्रवीकरण या द्रवण (LIQUIFACTION OF GASES)
जैसा कि हम क्रान्तिक घटनाओं में देख चुके हैं कि किसी गैस को द्रवित करने के लिए पहले उसे क्रान्तिक ताप से नीचे तक ठण्डा करना चाहिए क्योंकि क्रान्तिक ताप से ऊपर हम गैस के दाब को चाहे जितना बढ़ा दें उसका द्रवण नहीं हो सकता। अतः गैसों को पहले क्रान्तिक ताप से नीचे तक ठण्डा किया जाता है और फिर इन्हें सम्पीडित किया जाता है।
शीतलन के सिद्धान्त (Theories of Cooling) – गैसों का शीतलन करके उन्हें उनके क्रान्तिक ताप से नीचे तक ठण्डा करने के लिए दो सिद्धान्त लागू किये जा सकते हैं
(i) जूल-टॉमसन प्रभाव (Joule-Thomson’s effect) : जेम्स जूल (James Joule) तथा विलियम टॉमसन (William Thomson) ने बताया कि यदि किसी गैस को उच्च दाब से निम्न दाब की ओर फैलन। दिया जाये तो उसके ताप में कमी आती है और शीतलन (cooling) होता है। इसे जल-टॉमसन के नाम स । ही जूल-टॉमसन प्रभाव कहते हैं।
गैसों के अणुओं में विद्यमान अन्तराण्विक बल (Intermolecular force) के आधार पर इस प्रभाव। का आसानी से स्पष्टीकरण दिया जा सकता है। गैसों के अणु परस्पर प्रबल आकर्षण बल द्वारा जुड़े रहते हैं। ___ अब यदि इन्हें फैलने दिया जायेगा अर्थात् इनके मध्य की दूरी बढ़ायी जायेगी तो स्वाभाविक है कि इसक लिए इन्हें अन्तराण्विक आकर्षण बल के विरुद्ध कार्य करना पड़ेगा, इस कार्य के लिए तन्त्र (system) का अणओं की गतिज ऊर्जा से कुछ ऊर्जा लेनी होगी। गतिज ऊर्जा का मान कम होते ही शीतलन हो जायेगा क्योंकि गतिज ऊर्जा ताप के समानुपाती होती है और इस प्रकार गैसों का शीतलन हो जाता है। स्मरण रह कि यहां फैलने या विस्तार (Expansion) के लिए गैस ने कोई बाह्य कार्य नहीं किया है।
(ii ) वाष्पीकरण (Evaporation) – द्रवों के वाष्पीकरण से भी शीतलन होता है क्योंकि दर -होते हैं वे अपनी गतिज ऊर्जा बढ़ाने के लिए द्रव से ही ऊष्मा का अवशोषण करते – या उस सतह का ताप घट जाता है।
जुल – टामसनपर प्रभाव की शर्त या व्युत्क्रमण ताप (Condition of Joule-Thomson effect or in inversion) – प्रयोगों से ज्ञात हुआ कि जूल-टॉमसन प्रसार में गैसों का शीतलन केवल उस कि त उनका ताप किसी निश्चित मान से कम हो, और ताप के इस निश्चित मान को (inversion temperature) कहते हैं तथा इसे T द्वारा प्रदर्शित करते हैं। प्रत्येक गैस के लिए व्यत निश्चित मान होता है जो उसके वाण्डर वाल्स स्थिरांकों a तथा b के साथ निम्न प्रकार से सम्बनि न केवल उस स्थिति में होता येक गैस के लिए व्युत्क्रमण ताप का कुछ निश्चित होता है
T =2a/ Rb 2a ….(61)
व्युत्क्रमण ताप पर जूल-टॉमसन प्रभाव नहीं होता।
अतः यदि रुद्धोष्म रूप से (adiabatically) किसी छिद्रयुक्त ढक्कन (porous plug) में से किसी गैस को व्यक्रमण ताप पर बहुत कम दाब की ओर प्रसारित होने दिया जाये तो उसके ताप में कोई परिवर्तन नहीं आता, न कोई वृद्धि होती है और न ही कोई कमी। लेकिन यदि व्युत्क्रमण ताप के ऊपर गैस को प्रसारित होने दिया जाये तो ताप में वृद्धि हो जाती है और यदि व्युत्क्रमण ताप से कम ताप पर गैस को प्रसारित होने दिया जाये तो उसमें शीतलन (cooling) होता है।
अधिकांश गैसों के व्युत्क्रमण ताप का मान सामान्य परिसर (range) के भीतर होता है अतः वे जल-टॉमसन प्रसार से शीतल हो जाती हैं, लेकिन हाइड्रोजन (-80°C) व हीलियम (-240°C) के व्युत्क्रमण ताप बहुत कम हैं, अतः इन दोनों गैसों को क्रमशः -80°C व-240°C के व्युत्क्रमण ताप के नीचे तक ठण्डा करने के बाद इन्हें जूल-टॉमसन प्रभाव के अन्तर्गत प्रसारित होने दिया जाये तो इनमें शीतलन सम्पन्न किया जा सकता है।
- रुद्धोष्म प्रसार (Adiabatic expansion) – जब किसी गैस को दाब के विरुद्ध प्रसारित होने दिया जाता है तो उसे यान्त्रिकी कार्य (mechanical work) करना पड़ता है, इसके लिए गैस के अणुओं की गतिज ऊर्जा का कुछ भाग व्यय होता है और गतिज ऊर्जा के मान में कमी आते ही गैस का शीतलन हो जाता है।
(iv) अनुचुम्बकीय पदार्थों के रुद्धोष्म विचुम्बकन द्वारा (By the adiabatic demagnetization of paramagnetic substance) : क्षारीय मृदा धातु के लवणों जैसे चुम्बकीय पदार्थों के चुम्बकीय गुण की सहायता से भी परम शून्य तक का शीतलन उत्पन्न किया जा सकता है जिस पर गैसों का द्रवण हो सके। सर्वप्रथम डिबाई (Debye) ने 1926 में यह बताया कि अनुचुम्बकीय पदार्थों का रुद्धोष्म या ऐडियाबैटिक विचुम्बकन किया जा सकता है। बाद में 1927 में गियॉक (Giauque) ने बताया कि यदि किसी अनुचुम्बकीय पदार्थ का चुम्बकत्व नष्ट किया जाता है तो उसके ताप में कमी आ जाती है। जूल-टॉमसन सिद्धान्त के आधार पर गैसों के द्रवण के लिए निम्न विधियां हैं
(1) पुरानी रूढ़ पद्धतियां (Old classical methods) — सर्वप्रथम फैराडे (Faraday) ने 1823 में हिम मिश्रण (Freezing mixture) की सहायता से SO2, H2S,CO, आदि गैसों का द्रवण किया। इसके लिए उन्होंने एक V आकार की नली ली जिसकी एक भुजा में कोई पदार्थ लेकर गरम किया गया और उसकी दूसरी भुजा को सील करके हिम-मिश्रण में डुबो दिया गया। गैस के द्रवण के लिए दो शर्तों का पालन करना होता है—कम ताप व अधिक दाब। हिम-मिश्रण में गैस ठण्डी होती जायेगी और सीलबन्द नली क्रियाकारक में गैस बनती जायेगी तो स्वयं के दाब से उसका द्रवित गैस दाब बढ़ता जायेगा और गैस द्रवित हो जायेगी, जैसा कि चित्र 3.21 से स्पष्ट है। थिलोरिये (Thilorier) ने द्रवों के वाष्पीकरण द्वारा शीतलन का उपयोग करके मिश्रण गैसों का द्रवण सम्पन्न कराया। उन्होंने अधिक दाब सहन करने वाले उपर्युक्त उपकरण में कार्बन डाइ-ऑक्साइड का द्रवण किया। जब द्रव CO, स्वतः रूप से वाष्पीकृत होता है तो उसके शीतलन प्रभाव से शेष गैस ठोस में परिवर्तित हो जाती है। ठोस C. जिसे कि शुष्क बर्फ’ (dry ice) के नाम से जानते हैं, का ईथर के साथ मिश्रण एक उत्तम प्रशीतक की मांग व्यवहार करता है जिससे किसी गैस का शीतलन करके उसका द्रवण किया जा सकता है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics