limitations of thermodynamics in hindi ऊष्मागतिकी की सीमाएं क्या है लिखिए
ऊष्मागतिकी की सीमाएं क्या है लिखिए limitations of thermodynamics in hindi ?
अध्याय ऊष्मागतिकी -1 (THERMODYNAMICS-1)
विषय प्रवेश (Introduction)
ऊष्मागतिकी का शाब्दिक अर्थ ऊष्मा का प्रवाह है। अर्थात् ऊष्मा के प्रवाह के अध्ययन को ऊष्मागतिकी कहते हैं। यह एक गणितीय विज्ञान है, जिसके अन्तर्गत ऊष्मा का ऊर्जा के अन्य रूपों के साथ मात्रात्मक संबंधों (Quantitaive Relationship) का अध्ययन किया जाता है। ऊर्जा के विभिन्न रूपों जैसे यांत्रिक ऊर्जा, विकिरण ऊर्जा, विद्युत ऊर्जा तथा रासायनिक ऊर्जा आदि का दूसरे में तथा ऊष्मा में रूपान्तरण किया जा सकता है। इसे सामान्यतः ऊर्जा प्रक्रम (Energetics) भी कहा जाता है। ऊष्मागतिकी में इन रूपान्तरणों के नियमों का अध्ययन किया जाता है। ये नियम किसी सिद्धान्त पर आधारित नहीं है, बल्कि मानव के युगों से संचित अनुभवों पर आधारित हैं। इन नियमों का प्रायोगिक सत्यापन भी किया जा सकता है। इसीलिये ऊष्मा गतिकी को यथार्थ विज्ञान ( Exact Science) की संज्ञा दी जाती है। रासायनिक ऊष्मागतिकी, ऊष्मागतिकी की एक सीमित शाखा है जिसके अन्तर्गत रासायनिक पदार्थों के भौतिक रूपान्तरणों तथा रासायनिक अभिक्रियाओं के परिणामस्वरूप होने वाले ऊर्जा के परिवर्तनों का अध्ययन होता है।
कार्य करने की क्षमता को ऊर्जा कहते हैं। यह भली भाँति ज्ञात है कि यद्यपि ऊष्मा ऊर्जा को पूर्णतया कार्य में रूपान्तरित नहीं किया जा सकता है किन्तु कार्य को ऊष्मा ऊर्जा के समतुल्य में परिणित किया जा सकता है। जैम्स जूल ने 1840 में प्रदर्शित किया कि किए गए यांत्रिक कार्य (W) का परिमाण उत्पन्न ऊष्मा (H) के परिमाण का समानुपाती है। अर्थात्
जिसमें J जूल का ऊष्मा का यांत्रिक तुल्यांक (Mechanical Equivalent of Heat) है।
जब H = 1 कैलोरी हो तो W = J होगा
अतः जूल का ‘ऊष्मा का यांत्रिक तुल्यांक’ एक कैलोरी ऊष्मा उत्पन्न करने के लिए किए गये कार्य का परिमाण है। संख्यात्मक रूप से ऊर्जा की विभिन्न इकाईयाँ परस्पर निम्न प्रकार से संबंधित है-
1 कैलोरी = 4.185 जूल = 4. 185 x 107 अर्ग [1J = 107 ergs]
ऊष्मागतिकी की विषय वस्तु मुख्य रूप से चार मूलभूत नियमों पर आधारित है जो निम्न प्रकार है। भौतिक व रासायनिक रूपान्तरणों में निकाय की अवस्थाओं को वर्णित करने में ये नियम बड़े सरल तथा उपयोगी सिद्ध हुए है।
(i) शून्य नियम ( Zertoth law) यदि दो वस्तुऐं तापीय साम्य में है। तो उनमें ऊष्णता ( hotness) की मात्रा (ताप) समान होगी।
इसके अनुसार “यदि दो वस्तुऐं A तथा B किसी तीसरी वस्तु C के साथ पृथक-पृथक ऊष्मीय साम्य में हो तो A तथा B को एक साथ सम्पर्क में रखने पर वे भी परस्पर ऊष्मीय साम्य में होगी।
(ii) प्रथम नियम (First Law)- ब्रह्माण्ड की कुल ऊर्जा स्थिर होती है।
(iii) द्वितीय नियम (Second Law) – ब्रह्माण्ड की एन्ट्रॉपी ( entropy) बढ़ रही है।
(iv) तृतीय नियम (Third law) – पूर्ण क्रिस्टलीय पदार्थ की परम शून्य ताप पर एन्ट्रॉपी शून्य होती है। ताप दाब तथा सान्द्रण आदि में परिवर्तन से कोई भौतिक अथवा रासायनिक परिवर्तन या अभिक्रिया संभव स्वतः होगी या किसी बाहरी कारक के द्वारा होगी, अभिक्रिया साम्यवस्था में आ सकती है या नहीं, आदि प्रश्नों का उत्तर ऊष्मागतिकी के नियम बडी सहजता से देते हैं। ऊष्मागतिकी द्वारा विपुल पदार्थ (bulk matter) के गुणों का अध्ययन किया जाता है। ये गुण पदार्थ के स्थूल गुण (Macroscopic Properties) कहलाते हैं, जैसे दाब, ताप, आयतन, ऊर्जा आदि । भौतिक रसायन के कुछ नियमों जैसे-द्रव्य अनुपाती क्रिया नियम, तनु विलयनों के वॉन्ट हॉफ नियम, ऊष्मा रसायन के नियम, वितरण नियम, प्रावस्था, नियम, राऊल का नियम आदि को भी ऊष्मागतिकी द्वारा व्युत्पन्न किया जा सकता है।
ऊष्मागतिकी की सीमाएं (limitations of thermodynamics in hindi)
जसा का ऊपर बताया गया है। ऊष्मागतिका द्वारा पदार्थ के स्थूल गुणा का हा अध्ययन किया जाता है। परन्तु ऊष्मागतिकी द्वारा परमाणु या अणुओं की संरचना संबंधी जानकारी प्राप्त नहीं की जा सकती। निर्धारित परिस्थितियों मे कोई भौतिक अथवा रासायनिक परिवर्तन संभव है या नहीं या तो ऊष्मागतिकी द्वारा ज्ञात किया जा सकता है, परन्तु अभिक्रिया की दर या अभिक्रिया होने में लगने वाला समय
ज्ञात नहीं किया जा सकता। ऊष्मागतिकी पदार्थ या तंत्र की अवस्थाओं के अध्ययन में सहायक है परन्तु अवस्था परिवर्तनों की प्रक्रिया (क्रिया विधि) पर कोई प्रकाश नहीं डालती। अर्थात परिवर्तन क्यों होता है, इसका उत्तर तो ऊष्मागतिकी देती है, परन्तु परिवर्तन कैसे होता है, ऊष्मागतिकी बताने में असमर्थ हैं।
1.2 ऊष्मागतिकी पदों की परिभाषाएं (Definitions of thermodynamic Terms)
तंत्र अथवा निकाय (System) ब्रह्माण्ड का वह भाग जिसका ऊष्मागतिकी अध्ययन के लिये चयन किया जाता हैं तंत्र अथवा निकाय कहलाता है तंत्र ब्रह्माण्ड के शेष भाग से वास्तविक या काल्पनिक सीमाओं द्वारा पृथक होता है ।
पारिपाश्विक (Surroundings) तंत्र या निकाय के अतिरिक्त ब्रह्माण्ड का शेष भाग पारिवाश्विक कहलाता है।
उदाहरणार्थ – एक पात्र में भरी गैस का ऊष्मागतिकी अध्ययन के लिये चयन किया जाता है तो पात्र में भरी गैस तंत्र कहलायेगी तथा ब्रह्माण्ड का शेष भाग जिसमें पात्र भी सम्मिलित है पारिपाश्विक कहलाएगा।
तंत्रों का प्रकार (Types of Systems )
(i) विलगित तंत्र (Isolated System) – वह तंत्र जो अपने पारिपार्शिवक से न तो ऊर्जा का और न ही द्रव्य का विनिमय करता है, विलगित तंत्र कहलाता है। अर्थात इसमें तंत्र के पदार्थ की मात्रा व ऊर्जा स्थिर रहती है। थर्मस में रखा जल एवं वाष्प तंत्र (चित्र 1.1c) विलगित तंत्र का उदाहरण है।
(ii) खुला तंत्र (Open System) – वह तंत्र जो अपने पारिपाश्विक से ऊर्जा और पदार्थ दोनों का ही विनिमय कर सके, खुला तंत्र कहलाता है। एक खुले पात्र में रखा गर्म जल या बीकर में उबलता जल (चित्र 1.1a) खुले तंत्र का उदाहरण है।
(iii) बन्द तंत्र (Closed System) वह तंत्र जो कि अपने पारिपार्शिवक के साथ केवल ऊर्जा का विनिमय तो कर सके परन्तु पदार्थ का विनिमय नही करता हो, बंद तंत्र कहलाता है। एक बन्द तंत्र में रखा जल वाष्प तंत्र (चित्र 1.1b) बन्द तंत्र का उदाहरण है। अर्थात् इसमें पदार्थ की मात्रा स्थिर रहती है तथा केवल ऊर्जा परिवर्तित होती है।
(iv) समांगी तंत्र (Homogeneous System)- यदि किसी तंत्र में उपस्थित सभी पदार्थ समान प्रावस्था (phase) में हो या रासायनिक संघटन एक सा हो तो वह तंत्र समांगी तंत्र कहलाता है। दूसरे शब्दों में यदि तंत्र के गुण उसके प्रत्येक भाग में समान हों तो वह तंत्र समांगी तंत्र कहलाता है। उदाहरणार्थ शुद्ध गैस अथवा गैसों का मिश्रण, नमक का जलीय विलयन आदि
(v) विषमांगी तंत्र (Hetrogenecous System) – यदि किसी तंत्र में दो अथवा दो से अधिक ऐसे भाग हो जिनकी संघटन संरचना एवं गुण भिन्न भिन्न हो एवं इन गुणों को पृथक करने वाली स्पष्ट सीमा रेखा हो तो वह तंत्र विषमांगी तंत्र कहलाता है। विषमांगी तंत्र में दो या दो से अधिक प्रावस्थाऐं होती है। उदाहरणार्थ ठोसों का मिश्रण, अघुलनशील द्रवों का मिश्रण पानी तथा कार्बन टेट्राक्लोराइड, पानी के सम्पर्क में बर्फ, पदार्थ का कोलाइडी विलयन आदि।.
तंत्र की अवस्था (State of System) – किसी तंत्र की अवस्था को पूर्ण रूप से निर्धारित करने वाले गुण सामान्यतया, ताप, दाब, आयतन तथा संघटन (composition) होते हैं। ये गुण अवस्था के चर या परिवर्ती (Variables of state) कहलाते हैं। इनके मान ज्ञात होने पर निकाय के अन्य गुणधर्म जैसे घनत्व, श्यानता, द्रव्यमान आदि स्वतः ही ज्ञात हो जाते हैं। एक तंत्र के लिये जब इन गुणों के मान निर्धारित कर दिये जाते हैं तो वह तंत्र निश्चित अवस्था तंत्र ( System in a state) कहलाता है। एक तंत्र में उपरोक्त वर्णित गुणों में अन्तर उसकी प्रारम्भिक एवं अन्तिम अवस्थाओं पर ही निर्भर करते हैं। अर्थात् उपरोक्त गुणों में परिवर्तन से तंत्र की अवस्था परिवर्तित होती है। वास्तविक व्यवहार में ताप, दाब, तथा आयतन में से कोई दो चर या दो परिवर्ती (Two variables) तंत्र की अवस्था निर्धारित करने के लिये पर्याप्त होते हैं क्योंकि तीसरा चर अन्य दो चरों के मानों पर निर्भर करता है। गैस समीकरण PV= nRT में इन दो चरों (सामन्यतया ताप और दाब) को स्वतंत्र चर (independent variables) तथा तीसरे चर (सामान्यताया आयतन) को परतंत्र चर (dependent variable) कहते हैं। अन्य प्रकार के निकायों के लिए संघटन की भी आवश्यकता होगी अतः कुल तीन चर ज्ञात या परिवर्ती ज्ञात होना आवश्यक है।
ऊष्मागतिकी साम्य (Themodynamic Equilibrium)
जब किसी तंत्र का कोई भी प्रेक्षणीय गुणधर्म या स्थूल गुणों (macroscopic properties) जैसे – ताप, दाब, आदि में समय के साथ परिवर्तन नहीं होता है तो वह तंत्र ऊष्मागतिक साम्य में होता है। ऊष्मागतिकी साम्य में तीन प्रकार के साम्य निहित है-
(i) तापीय साम्य (Thermal Equilibrium) – यदि समय के साथ तंत्र अथवा निकाय के किसी भाग का ताप नहीं बदले या यदि तंत्र में एक भाग में दूसरे भाग से ऊष्मा का प्रवाह न हो अर्थात सम्पूर्ण तंत्र में सर्वत्र ताप एक समान हो तो तंत्र तापीय साम्य में कहलाता है।
(ii) रासायनिक साम्य (Chemical Equilibrium)- यदि समय के साथ तंत्र में उपस्थित विभिन्न प्रावस्थाओं में संघटन में परिवर्तन न हो तो वह तंत्र रासायनिक साम्य में कहलाता है। अर्थात् सान्द्रताओं में परिवर्तन नहीं होता है।
(iii) यांत्रिक साम्य (Mechanical Equilibrium)- यदि किसी तंत्र का एक भाग दूसरे भाग पर कोई यांत्रिक कार्य नहीं करे अर्थात तंत्र के अन्दर या उसकी सीमाओं पर पदार्थ का प्रवाह न होता हो तो वह तंत्र यांत्रिक साम्य में कहलाता है। यह तब ही संभव है जब कि पूरे तंत्र में सर्वत्र दाब समान हो।
1.5 तंत्र के गुण (Properties of System)
तंत्र के गुणों को दो भागों में विभाजित किया जा सकता है-
(i) मात्रात्मक या विस्तीर्ण गुण (Extensive Properties) – वे गुण जो कि तंत्र में उपस्थित पदार्थ या पदार्थों की मात्रा पर निर्भर करते हैं, तंत्र के मात्रात्मक गुण कहलाते हैं। उदाहरणार्थ आयतन द्रव्यमान, ‘अणुओं की संख्या, ऊर्जा, ऊष्मा की मात्रा, ऊष्माधारिता, ऐन्ट्रॉपी, आन्तरिक ऊर्जा, गिब्स मुक्त ऊर्जा आदि। ये गुण पदार्थ की मात्रा से परिवर्तित होते हैं।
(ii) मात्रा स्वतंत्र या विशिष्ट या गहन गुण (Intensive Properties) – वे गुण जो कि तंत्र में उपस्थित पदार्थ या पदार्थों की मात्रा पर निर्भर नहीं करते हैं, बल्कि पदार्थ की प्रकृति पर निर्भर करते हैं। तंत्र के मात्रा स्वतंत्र या विशिष्ट गुण या गहन गुण कहलाते हैं। उदाहरणार्थ- ताप, दाब, सान्द्रता, घनत्व, श्यानता, अपवर्तनांक, पृष्ठ तनाव, विशिष्ट ऊष्मा, द्विध्रुव आघूर्ण, परावैद्युत स्थिरांक, मोलर ऐन्द्रापी, क्वथनांक, हिमांक, गैस स्थिरांक (R) आदि ।
उदहारणार्थ–एक किलो जल लो या दस किलों जल इनका अपवर्तनांक, पृष्ठ तनाव, श्यानता, घनत्व, ताप दोनों में समान होता है।
इसी प्रकार मोल भिन्न, मोलरता, नार्मलता भी तंत्र के विशिष्ट (गहन) गुण है क्योंकि ये समांगी मिश्रण के प्रत्येक भाग के लिए समान है। जबकि अणुओं की संख्या विस्तीर्ण गुण है ।
मात्रात्मक ( विस्तीर्ण) गुणों का विशिष्ट गुणों में परिवर्तन :- जब पदार्थ इकाई मात्रा में हो तो विस्तीर्ण गुण विशिष्ट गुण बन जाता है। उदाहरणार्थ द्रव्यमान तथा आयतन मात्रात्मक ( विस्तीर्ण) गुण है परन्तु द्रव्यमान प्रति इकाई आयतन (घनत्व) तथा आयतन प्रति इकाई द्रव्यमान (विशिष्ट आयतन) विशिष्ट गुण है। इन प्रकार के परिवर्तनों को निम्न सारणी में दर्शाया गया है।
ऊष्मागतिकी प्रक्रम (Thermodynamic Process)
वह प्रक्रिया या संक्रिया (operation) जिसके द्वारा तंत्र की एक अवस्था दूसरी अवस्था में परिवर्तित होती है। ऊष्मागतिकी प्रक्रम कहलाता है।
तंत्र की अवस्था में परिवर्तन निम्नलिखित प्रक्रमों द्वारा किया जा सकता है-
(i) समतापी प्रक्रम (Isothermal Process)- यह प्रक्रम समतापी प्रक्रम कहलाता है जिसके प्रत्येक पद में ताप स्थिर रहे। ताप स्थिर रखने के लिये तंत्र अपने पारिपाश्विक से ऊष्मा का विनिमय करने के लिये स्वतंत्र होता है। यदि प्रक्रम ऊष्माक्षेपी होता है तो मुक्त हुई ऊष्मा पारिवाश्विक को दे दी जाती है। और यदि प्रक्रम ऊष्माशोषी होता है तो पारिपाश्विक से ऊष्मा ले ली जाती है। ताकि तंत्र का ताप समान (स्थिर) रह सके। यदि ताप T तथा आन्तरिक ऊर्जा E हो तो समतापी प्रक्रम के लिए IT = 0 होता है व dE = 0 भी होगा।
(ii) रूद्धोष्म प्रक्रम (Adiabatic Process)- इस प्रकार के प्रक्रम में तंत्र अपने पारिपाश्विक से ऊष्मा का विनिमय नहीं करता है। इस प्रक्रम में तंत्र के ताप में परिवर्तन संभव है। यदि प्रक्रम ऊष्माक्षेपी होता है तो ताप में वृद्धि होती है, और यदि प्रक्रम ऊष्माशोषी होता है तो ताप में कमी हो जाती है यदि ऊष्मां को 9 से व्यक्त किया जाए तो रूद्धोष्म प्रक्रम के लिए dq = 0 होता है।
(iii) समदाबी प्रक्रम (Isobaric or Isopisestic Process) वह प्रक्रम जिसके द्वारा अवस्था परिवर्तन में दाब स्थिर रहे, समदाबी प्रक्रम कहलाता है। यदि निकाय का दाब P हो तो समदाबी प्रक्रम के लिये dP = 0 होता है। जैसे 25°C तथा एक वायुमण्डलीय दाब वाले 1.0 मोल जल का 100°C तथा एक वायुमण्डलीय दाब पर वाष्प में परिवर्तन समदाब या समदाबी प्रक्रम का उदाहरण है ।
(iv) समआयतनिक प्रक्रम ( Isochoric Process) – जिस प्रक्रम के प्रत्येक पद में तंत्र का आयतन समान (स्थिर) रहे वह प्रक्रम समआयतनिक प्रक्रम कहलाता है। समआयतनी प्रक्रम के लिए (aV= 0) जहाँ V तंत्र का आयतन है।
(v) चक्रीय प्रक्रम (Cyclic Process) – यदि कोई तंत्र अवस्था परिवर्तनों की श्रृंखला में से गुजरते हु पुनः अपनी प्रारम्भिक अवस्था में आ जाये तो वह प्रक्रम चक्रीय प्रक्रम कहलाता है।
(vi) पथ (Path) तंत्र के प्रारम्भिक अवस्था से प्रारम्भ कर माध्य अवस्थाओं से गुजरकर अन्तिम अवस्था में पहुँचने को तंत्र का पथ कहते हैं। जैसे 25°C व एक वायुमण्डलीय दाब वाले एक मोल जल को 100°C व एक वायुमण्डलीय दाब की वाष्प में बदलने के पथ को इस प्रकार प्रदर्शित करते हैं-
जहाँ (a), (b), (c) आदि माध्य अवस्थाऐं है तथा पूरे तंत्र का पथ उपरोक्तानुसार है।
(vii) उत्क्रमणीय तथा अनुत्क्रमणीय प्रक्रम (Reversible and Irreversible Process)- यदि किसी प्रक्रम में प्रेरक बल (driving force) की मात्रा प्रतिरोधी बल (opposing force) की मात्रा से अनन्त सूक्ष्म (infinitesimal) अधिक हो अर्थात् प्रक्रम अनंत सूक्ष्म धीमी गति से हो तो वह प्रक्रम उत्क्रमणीय प्रक्रम कहलाता है। वोल्टीय सैल से सूक्ष्म मात्रा से विद्युत प्रवाह इसका अच्छा उदाहरण है। उत्क्रमणीय प्रक्रम में तंत्र की अवस्था के चर (दाब, ताप आदि) पारिपारिवक के अथवा चरों से अनन्त सूक्ष्म अधिक होते हैं और यह माना जाता है कि तंत्र अपने पारिपाश्विक के साथ हमेशा साम्यवस्था में रहता है। उदाहरणार्थ एक तंत्र अपने पारिपाश्विक से ऊष्मा का अवशोषण उत्क्रमणीय रूप से करता है। इसका तात्पर्य यह है कि पारिपार्शिवक का ताप तंत्र के ताप से केवल अनंत सूक्ष्म अधिक हो तब ही ऊष्मा का विनिमय अनंत सूक्ष्म गति से संभव है। यदि तंत्र का ताप पारिपाश्विक के ताप से अनन्त सूक्ष्म बढ़ा दिया जाए तो तंत्र ऊष्मा का उत्सर्जन करने लगेगा अर्थात् प्रक्रम उत्क्रमित (revrse) हो जाता है।
अतः तंत्र हमेशा ही अर्थात प्रत्येक क्षण अपने पारिपाश्विक से साम्यावस्था में रहता है तथा पारिपार्शिवक के फलनों में अनन्त सूक्ष्म अन्तर कर देने पर प्रक्रम उत्क्रमित किया जा सकता है।
यदि प्रक्रम बहुत तीव्र गति से होता है अथवा स्वतः ( spontaneous) होता है तो वह प्रक्रम अनुत्क्रमणीय प्रक्रम कहलाता है। इस प्रकार के प्रक्रम में तंत्र की अवस्था के चर पारिपाश्विक अवस्था चरों से परिमित (finite) मात्रा में भिन्न होते हैं। इसीलिये तंत्र अपने पारिवाश्विक के साथ साम्यावस्था में नहीं रहता।
गैसों का आपस में मिश्रित होना, पदार्थ का किसी विलायक में घुलना, गैस का शून्य (vaccum) में प्रसार, दूध से दही बनना आदि अनुत्क्रमणीय प्रक्रम के अच्छे उदाहरण है।
उत्क्रमणीय एवं अनुउत्क्रमणीय प्रक्रम में अन्तर निम्नलिखित उदाहरण से समझा जा सकता है।
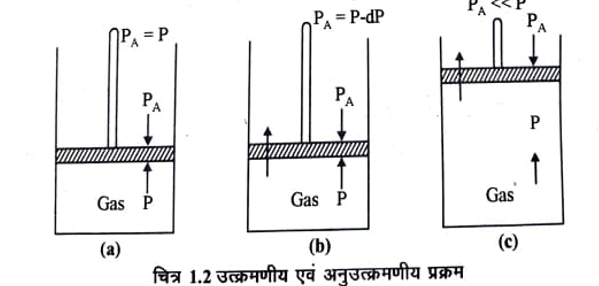
माना कि एक सिलिण्डर में वायुरोधी, भारहीन तथा घर्षणहीन पिस्टन लगा हुआ है। इस सिलिण्डर में एक गैस की कुछ मात्रा भरी है। प्रथम स्थिति में माना कि पिस्टन स्थिर है (चित्र 1.2a) अर्थात् पिस्टन पर लगने का वाला दाब (प्रेरकबल), गैस के दाब (प्रतिरोधी बल) के बराबर है। यदि P पिस्टन पर लगाया दाब (applied pressure) तथा P गैस का दाब हो तो P = P जब तक ये दोनों बराबर है, निकाय ठीक साम्यवस्था में रहता है।
यह पिस्टन पर लगाया दाब गैस के दाब से अनन्त सूक्ष्म मात्रा dP से घटा दिया जाता है, अर्थात् PA = P – dP (चित्र 1.2b) तो पिस्टन कुछ ऊपर की ओर चलेगा। अतः गैस का प्रसार होगा अनन्त सूक्ष्म मात्रा से आयतन में वृद्धि हो जायेगी। यदि पिस्टन का दाब गैस के दाब से अनन्त सूक्ष्म कम रखा जाये तो गैस के आयतन में वृद्धि अनन्त सूक्ष्म मात्रा से होती जायेगी। ऊष्मागतिकी के अनुसार यह गैस का उत्क्रमणीय प्रसार कहलायेगा । यदि पिस्टन पर लगे दाब को गैस के दाब से बहुत कम कर दिया जाये अर्थात PA << P(चित्र 1.2c) तो गैस का प्रसार बहुत तेजी से होगा और पिस्टन ऊपर की ओर तीव्र गति से चलेगा। यह गैस का अनुत्क्रमणीय प्रसार कहलायेगा ।
उत्क्रमणीय प्रसार आदर्श प्रक्रम होते हैं। इसको व्यवहार में अनुभव नहीं कर सकते। क्योंकि इसे पूर्ण होने में अनन्त समय लगता है। अतः प्राकृतिक और प्रयोगशालाओं में घटित लगभग सभी प्रक्रम अनुत्क्रमणीय होते हैं। अर्थात किसी प्रक्रम को व्यवहारिक रूप में उत्क्रमणीय बनाना संभव नहीं होता क्योंकि किसी गुण को अनन्त सूक्ष्म मात्रा से परिवर्तित करना संभव नहीं है। उत्क्रमणीय प्रक्रम पूर्णतः काल्पनिक तथा सैद्धान्तिक है । परन्तु उत्क्रमणीय की धारणा से कुछ महत्वपूर्ण एवं उपयोगी निष्कर्ष व्युत्पन्न किये जा सकते हैं।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics