limitations of arrhenius theory in hindi आरेनियस सिद्धांत की सीमाएं क्या है उदाहरण सहित
आरेनियस सिद्धांत की सीमाएं क्या है उदाहरण सहित limitations of arrhenius theory in hindi ?
आयनों की गति (Speed of Ions), आयनिक गतिशीलता (lonic Mobilities)
यद्यपि अनन्त तनुता पर प्रत्येक विद्युत अपघट्य पूर्ण रूप से आयनित हो जाता है फिर भी तुल्यांकी चालकता एक दूसरे से बहुत भिन्न होती है।
इसका मुख्य कारण उनके आयनों की विभिन्न गति है। उदाहरणार्थ अनन्त तनुता पर HCI की तुल्यांकी चालकता NaCl की तुल्यांकी चालकता से लगभग तीन गुना अधिक है जबकि दोनों में क्लोराइड आयन उभयनिष्ठ (Common) है इससे यह बात स्पष्ट है कि H+ आयन की गति Na+ से तीन गुना अि कहै ।
चूंकि आयन की गति दिये गये विभव के साथ बदल जाती है इसलिए इसकी गति के लिए आयनिक गतिशीलता (ionic mobilities) शब्द का प्रयोग किया जाता है। इसे निम्न प्रकार परिभाषित करते हैं।
एक वोल्ट प्रति सेमी विभव प्रवणता पर किसी आयन द्वारा प्रति सैकेण्ड में तय की गयी दूरी आयनिक गतिशीलता (lonic mobilities) कहलाती है।
आयनिक चालकता और आयनिक गतिशीलता दोनों पद भिन्न होते हैं तथा वे एक दूसरे के समानुपाती होते हैं।
अतः अनन्त तनुता पर
जहाँ U और V क्रमशः धनायन व ऋणायन की आयनिक गतिशीलताऐं या निरपेक्ष गतियाँ (absolute velocities) तथा धनायन तथा ऋणायन की तुल्यांकी आयनिक चालकताऐं हैं।
……………(26)
जहाँ k सभी विद्युत अपघटयों के लिए एक स्थिरांक है। आयनिक चालकता ओम -1 ओर आयनिक गतिशीलता एक ईकाई विभव प्रवणता (potential gradient) के लिए सेमी. प्रति सैकण्ड में व्यक्त करते हैं। ऐसी स्थिति में k का मान एक फैराडे या 96500 कूलॉम के बराबर होता है। और इसे F द्वारा प्रदर्शित किया जाता है। अतः
दूसरे शब्दों में किसी आयन की गतिशीलता निकालने के लिए आयनिक चालकता में 96500 का भाग देते हैं। उदाहरण 25° C पर H’ आयन की अनन्त तनुता पर चालकता (H+) = 349.8 है अतः इसकी
सारणी 5.6 में कुछ आयनों की आयनिक गतिशीलताऐं दी गई है।
का निर्धारण (Determination of )- कोलराऊस ने प्रबल विद्युत अपघट्यों के में आलेख खींचा जो रेखीय है, चित्र 5.6 उसका बर्हिवेशन कर अनन्त तनुता पर प्रबल विद्युत अपघटयों की तुल्यांकी चालकता ज्ञात की लेकिन दुर्बल विद्युत अपघट्य जो विलयन में पर्याप्त सीमा तक आयनित नहीं होते और अत्यधिक तनुता पर भी पूर्णतः आयनित नहीं हो पाते ऐसी दशा में दुर्बल विद्युत अपघटयों के लिए का प्रायोगिक निर्धारण संभव नहीं है। किन्तु कोलराऊस नियम की सहायता से निम्न दो विधियों में से किसी एक द्वारा उसकी गणना की जा सकती है।
(1) इस विधि में धनायन व ऋणायन की तुल्यांकी आयनिक चालकताओं की गणना करके दोनों को जोड़ देने पर दुर्बल विद्युत अपघटय की अनन्त तनुता पर तुल्यांकी चालकता ज्ञात हो जाती है।
लेकिन किसी आयन की आयनिक तुल्यांकी चालकता ऐसे किसी प्रबल विद्युत अपघट्य की जिसमें वह आयन हो अनन्त तनुता पर उसकी तुल्यांकी चालकता को उसके अभिगमनांक (अभिगमनांक के बारे में विस्तृत अध्ययन इसी अध्याय में किया गया है) से गुणा करके ज्ञात कर सकते हैं। अर्थात
जहाँ na तथा nc क्रमशः धनायन व ऋणायन के अभिगमनांक हैं ।
आरेनियस का विद्युत अपघटनी वियोजन का सिद्धान्त (Arrhenius theory of Electrolytic dissociation)
आरेनियस ने सन् 1887 में विद्युत अपघटनी वियोजन सिद्धान्त प्रतिपादित किया जिसके द्वारा विद्युत अपघटयों के व्यवहार को समझाने में सहायता मिली और आधुनिक विवेचन का आधार भी तैयार हुआ है। आरेनियस सिद्धान्त के प्रमुख अभिगृहित निम्नलिखित हैं-
(i) जब किसी विद्युत अपघट्य को जल में घोला जाता है जो वह आवेशित कणों जिन्हें आयन (lons) कहते हैं, में वियोजित हो जाता है। धन आवेशित कणों को धनायन (Cations) तथा ऋण आवेशित कणों को ऋणायन (Anions) कहते हैं।
(ii) विद्युत क्षेत्र के प्रभाव में से आयन स्वतन्त्र रूप से गति करते हैं। धनायन कैथोड (Cathode) की ओर तथा ऋणायन ऐनोड (Anode) की ओर गति करते हैं तथा आयनों का यह गमन विलयन में विद्युत धारा के प्रवाहित होने के लिए उत्तरदायी होता है। चालकता आयनों की प्रकृति तथा उनकी संख्या पर निर्भर करती है।
(iii) विलयन में धनायनों एवं ऋणायनों की संख्या भिन्न-भिन्न हो सकती हैं, परन्तु धनायनों एवं ऋणायनों पर कुल आवेश समान होता है। अर्थात् विलयन विद्युत उदासीन होता है।
(iv) यह आवश्यक नहीं है कि सम्पूर्ण विद्युत अपघट्य का वियोजन हो। कुल विद्युत अपघट्य की वह भिन्न जो वियोजित होती है, वियोजन की मात्रा (Degree of dissociation) कहलाती है। वियोजन की मात्रा ताप, तनुता, विलायक तथा विद्युत अपघट्य की प्रकृति पर निर्भर करती है।’
(v) विलयन में आयनों तथा अवियोजित अणुओं के मध्य साम्य स्थापित हो जाता है, यह साम्य आयनिक साम्य (Ionic Equilibrium) कहलाता है।
किसी विद्युत अपघट्य AB के लिए
AB → A + B
(vi) विद्युत अपघट्य के गुण उसके आयनों के गुण होते हैं। विलयन के परासरण दाब, वाष्प दाब अवनमन, हिमांक अवनमन, क्वथनांक उन्नयन आदि अणु संख्य गुण (Colligative properites) के संदर्भ में प्रत्येक आयन एक कण (particle) के समान व्यवहार करता है। कोई अणु यदि आयनित होकर दो आयन देता हो तो उसका प्रभाव दो अणुओं के बराबर होगा ।
उपरोक्त अभिगृहितों के आधार पर ही आरेनियस “तनुता के साथ तुल्यांकी चालकता के मान में वृद्धि” को समझा सका । वियोजन की मात्रा चूंकि तनुता (अथवा सान्द्रता) पर निर्भर करती है, अतः तनुता के साथ विलयन में आयनों की मात्रा में भी वृद्धि होती है। परिणामस्वरूप तुल्यांकी चालकता भी बढ़ती है। अनन्त तनुता ( Infinite dilution) पर विद्युत अपघट्य पूर्ण रूप से आयनित हो जाता है,
फलस्वरूप तुल्याकी चालकता भी अधिकतम हो जाती है। अतः वियोजन की मात्रा (c) का मान निम्न समीकरण द्वारा व्यक्त किया जा सकता है।
यहाँ एक विशेष तनुता V पर तथा अनन्त तनुता पर तुल्यांकी चालकताऐं है।
आरेनियस सिद्धान्त की सीमाएँ (Limitations of Arrhenius Theory)
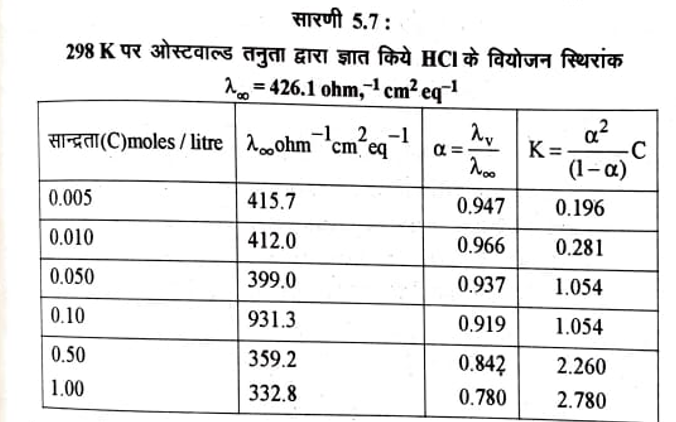
यद्यपि आरेनियंस के सिद्धान्त की पुष्टि के लिए अनेक प्रमाण उपलब्ध है, परन्तु जैसे-जैसे प्रायोगिक तथ्यों का पता लगता गया, इस सिद्धान्त में अनेकों विसंगतियाँ मिलती गई। इस प्रकार यह सिद्धान्त सीमाओं में ही लागू किया जा सका। आरेनियम सिद्धान्त की कुछ प्रमुख सीमाएँ निम्नलिखित हैं- (i) आरेनियस सिद्धान्त पर आधारित ओस्टवाल्ड तनुता नियम प्रबल विद्युत अपघट्यों के लिए अपेक्षित परिणाम नहीं देता। अर्थात् वियोजन स्थिरांक का मान स्थिर प्राप्त नहीं होता | HCI के वियोजन स्थिरांकों के परिकलित मान ओस्टवाल्ड नियम द्वारा सारणी 5.7 में दिखाये गये हैं।
(2) प्रबल विद्युत अपघट्यों के लिए चालकता मापन द्वारा प्राप्त के मान, वान्टॉफ गुणांक द्वारा प्राप्त के मानों के समान नहीं पाये जाते ।
(3)KCI, NaOH, NaCl आदि प्रबल विद्युत अपघट्य पिघली अवस्था (molten state) में भी विद्युत सुचालक होते हैं। इससे इस बात की पुष्टि होती है कि वियोजन जल की अनुपस्थिति में भी संभव है।
(4) आरेनियस सिद्धान्त में आयनों के अस्तित्व को माना गया है, परन्तु विपरीत आवेशित आयनों के मध्य आकर्षण का ध्यान नहीं रखा गया है, दुर्बल विद्युत अपघट्यों में चूंकि आयनों की संख्या कम होती है अतः इनमें आकर्षण कम हो सकते हैं, परन्तु प्रबल विद्युत अपघट्यों के सान्द्र विलयन में अन्तरा आयनिक आकर्षण प्रबल होते हैं। अतः विलयन के गुण प्रभावित हो सकते हैं।
(5) NaCl, KCI, Na2SO4 आदि प्रबल अपघट्यों के क्रिस्टलों के अध्ययन से ज्ञात हुआ है कि इनकी ठोस अवस्था में भी आयन ही उपस्थित हैं। अतः अवियोजित अणुओं का अस्तित्व ही नहीं होता है और इसीलिए ही अवियोजित अणुओं तथा आयनों में साम्य संभव नहीं हैं।
(6) प्रबल विद्युत अपघट्यों के तनु विलयनों के अवशोषण स्पेक्ट्रम भी अवियोजित अणु-के अस्तित्व को प्रमाणित नहीं करते हैं।