hydrogen bonding in hindi types हाइड्रोजन बंध क्या है उदाहरण सहित समझाइए किसे कहते हैं यह कितने प्रकार के होते हैं
हाइड्रोजन बंध क्या है उदाहरण सहित समझाइए किसे कहते हैं यह कितने प्रकार के होते हैं hydrogen bonding in hindi types ?
रेपे संश्लेषण (Reppe’s Synthesis) :-
तृतीयक ऐमीन आयरन कार्बोनिल उत्प्रेरक की उपस्थिति में ऐल्कीन कार्बन मोनो ऑक्साइड तथा जल के साथ अभिक्रिया पर ऐल्कोहोल देता है।
(नोटः इस अभिक्रिया में मेथिल ऐमीन नाइट्रस अम्ल के साथ मेथेनॉल न देकर मेथॉक्सी मेथेन देता
भौतिक गुण (Physical properties) निम्नतर ऐल्केनॉल (C, से C11 तक) रंगहीन, तीखे स्वाद एवं गंध वाले वाष्शील द्रव होते हैं। इससे आगे के सदस्य मोम के समान ठोस होते हैं। अणुभार बढ़ने पर ऐल्केनॉल का तीखापन तथा गन्ध कम होती जाती है। ऐल्केनॉल का स्वापक प्रभाव (Narcotic action) होता है। मेथेनॉल तंत्रिका विष का कार्य करता है और थोड़ी मात्रा में लेने पर अंधेपन का कारण बन जाता है। इसी प्रकार एथेनॉल एक उत्तेजक (Stimulant) पदार्थ है जो केन्द्रीय नाड़ी तंत्र पर अवनयक (Depressant) का कार्य करता है जिससे शरीर का ताप कम हो जाता है और बेहोशी उत्पन्न हो जाती है। शाखित श्रृंखला वाले (तृतीयक ) ऐल्केनॉल अधिक स्वापन प्रभाव दर्शाते हैं। अतः इनका प्रयोग सम्मोहक (Hypnotic ) तथा शामक (sedative) के रूप में किया जाता है। सामान्य रूप से द्रव ऐल्केनॉल का विषैला प्रभाव अणु भार बढ़ने पर बढ़ता है।
ऐल्केनॉल का क्वथनांक ‘CH2’ समूह बढ़ने के साथ बढ़ जाता है। निम्नतर सदस्यों में यह अन्तर लगभग 20K का है। ऐल्केनॉल का क्वथनांक कार्बन श्रृंखला के शाखित होने पर कम हो जाता है। अतः समावयवी ऐल्केनॉल में क्वथनांक का क्रम 1° > 2° > 3° है । ऐल्केनॉल का क्वथनांक संगत ऐल्केन या लगभग समान अणुभार वाले यौगिक जैसे- ईथर एवं ऐल्किल हैलाइड आदि से अधिक होता है। इनके क्वथनांक अधिक होने की व्याख्या हाइड्रोजन बन्ध द्वारा की जा सकती है।
निम्नतर ऐल्केनॉल जल में पूर्णतया घुलनशील हैं क्योंकि ये जल के साथ अन्तरा अणुक हाइड्रोजन बंध बना लेते हैं । ब्यूटेनॉल से आगे बढ़ने पर इनकी घुलनशीलता कम हो जाती है क्योंकि हाइड्रोकार्बन भाग (ऐल्किल समूह) बढ़ने पर विलेयता कम होती है। हाइड्रोकार्बन भाग जल प्रतिकर्षित होता है।
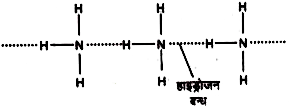
हाइड्रोजन बन्धन (Hydrogen bonding)
प्रबल विद्युतऋणी तत्वों जैसे – F. O, N आदि के हाइड्रोजन के साथ बने बन्ध में बन्धित – इलेक्ट्रॉन युग्म हाइड्रोजन से दूर ओर विद्युतऋणी परमाणु के नजदीक आ जाता है। इस कारण हाइड्रोजन पर आंशिक धनावेश और विद्युतऋणी तत्व के परमाणु पर आंशिक ऋणावेश आ जाता है। उदाहरणार्थ- 0 —H बन्ध में हाइड्रोजन और ऑक्सीजन के बीच का इलेक्ट्रॉन युग्म ऑक्सीजन की ओर अधिक होने के कारण यह ऑक्सीजन आंशिक ऋणावेशित और हाइड्रोजन आंशिक धनावेशित हो जाता है।
उदाहरणार्थ-ऐल्केनॉल में एक अणु के OH समूह का आंशिक धनावेशित हाइड्रोजन परमाणु दूसरे अणु के OH समूह के आंशिक ऋणावेशित ऑक्सीजन परमाणु को अपनी ओर आकर्षित करता है तथा स्वयं उसके द्वारा आकर्षित होता है। इस प्रकार उनके मध्य एक स्थिर वैद्युत आकर्षण बल स्थापित हो जाता है और दो या दो से अधिक अणु आपस में जुड़कर एक संगुणित अणु बनाते हैं। इन अणुओं का इस प्रकार से जुड़ना आण्विक संगुणन (Molecular association) कहलाता है। ऐल्केनॉल अणुओं के गुणन को निम्न प्रकार प्रदर्शित किया जा सकता है-
बिन्दुदार रेखाओं द्वारा प्रदर्शित बन्धों को हाइड्रोजन बन्ध कहते हैं। अतः एक अणु के विद्युतऋणी परमाणु से बन्धित हाइड्रोजन और दूसरे अणु के विद्युतऋणी परमाणु के मध्य उपस्थित यह स्थिर वैद्युत आकर्षण बल हाइड्रोजन -बन्ध कहलाता है। हाइड्रोजन बन्ध की ऊर्जा लगभग 3-10 कि. कैलोरी प्रति मोल होती है जो सहसंयोजक बंध की ऊर्जा से बहुत कम होती है।
हाइड्रोजन बन्ध के प्रकार (Types of hydrogen bond) हाइड्रोजन-बन्ध दो प्रकार के होते हैं- (i) अन्तराअणुक हाइड्रोजन – बन्ध ( Inter molecular hydrogen bond) (ii) अन्तः अणुक हाइड्रोजन – बन्ध ( Intramolcular hydrogen bond)
(i) अन्तराअणुक हाइड्रोजन बन्ध– दो अणुओं में से एक अणु हाइड्रोजन एवं दूसरे अणु के विद्युतऋणी परमाणु के मध्य बनने वाला हाइड्रोजन बन्ध अन्तरा अणुक हाइड्रोजन-बन्ध कहलाता है । जैसे- जल, ऐल्केनॉल, एवं ऐसीटिक अम्ल में अन्तरा अणुक हाइड्रोजन बन्ध निम्नानुसार प्रदर्शित किया जा सकता है।
(ii) अन्तः अणुक हाइड्रोजन बन्ध– एक ही अणु में उपस्थित हाइड्रोजन तथा विद्युतऋणी परमाणु के मध्य बनने वाला हाइड्रोजन बन्ध अन्तः अणुक हाइड्रोजन – बन्ध कहलाता है । उदाहरणार्थ- यह हाइड्रोजन बन्ध आर्थो— क्लोरोफीनॉल, सैलिसिल- ऐल्डिहाइड और ऑर्थोनाइट्रोफीनॉल आदि में पाया जाता है ।
हाइड्रोजन बन्ध के प्रभाव (Effects of Hydrogen bond) – अन्तराअणुक हाइड्रोजन बन्ध से कारण यौगिक के एक से अधिक अणुओं का संगुणन हो जाता है। जिससे उनके मध्य आकर्षण बढ़ जाता फलस्वरूप गलनांक व क्वथनांक के मान अधिक हो जाते हैं, क्योंकि इन हाइड्रोजन बन्धों को तोड़ने के लिए अतिरिक्त ऊर्जा की आवश्यकता होती है । ऐल्केनॉल के अणुओं में भी अन्तराणुक हाइड्रोजन बन्ध के कारण आण्विक संगुणन हो जाता है, जिसके फलस्वरूप इनके अन्य यौगिकों जैसे-ऐल्केन, ऐल्किल हैलाइड, ईथर आदि से अधिक इसी प्रकार ऐसे अणु जो जल के अणुओं के साथ हाइड्रोजन – बन्ध हो जाते हैं। यही कारण है कि निम्नतर ऐल्केनॉल जल में विलय हैं, जबकि उच्चतर ऐल्केनॉल में साथ हाइड्रोजन बन्ध बनाने की हाइड्रोकार्बन भाग बड़ा हो जाने के कारण उनकी जल के अणुओं सामर्थ्य कम हो जाती है और फलस्वरूप जल में विलेयता घट जाती है।
अन्तःअणुक हाइड्रोजन – बन्ध से वलय बनने अथवा कीलेशन (Chelation) की स्थिति हो जाती है और कीलेशन से द्रवणांक व क्वथनांक में कमी आ जाती है। o- नाइट्रोफीनॉल में कीलेशन सम्भव है अतः इसका द्रवणांक कम है और यह एक वाष्पशील पदार्थ है ।
ऐल्कोहॉल की अम्लीय प्रकृति (Acidic Nature of Alcohol)
इसके लिए देखें ऐल्कोहॉल की वे अभिक्रियायें जिनमें RO – H बन्ध टूटता है खण्ड 2.7.2 (i)
ऐल्कोहॉल की अभिक्रियायें (Reactions of Alcohols)
ऐल्कोहॉल की वे अभिक्रियायें जिनमें C—OH बन्ध टूटता है (Reactions of alcohols which involve breaking of C-OH bond)
(1) हाइड्रोजन हैलाइड के साथ अभिक्रिया:- ऐल्केनॉल हाइड्रोजन हैलाइड से सुगमता से अभिक्रिया करके प्रतिस्थापन अभिक्रिया द्वारा ऐल्किल हैलाइड देते हैं। ऐल्केनॉल की HBr और HI से अभिक्रिया पर क्रमशः ऐल्किल ब्रोमाइड और ऐल्किल आयोडाइड बनते हैं, जबकि सान्द्र HCl के साथ शुष्क ZnCl2 की उपस्थिति में अभिक्रिया कराने से ऐल्किल क्लोराइड प्राप्त होता है (ग्रोव प्रक्रम, Groves process)। ऐल्किल ब्रोमाइड बनाने के लिए HBr को NaBr तथा H2SO4 की अभिक्रिया से प्राप्त किया जाता है।
हाइड्रोजन हैलाइड की. क्रियाशीलता का क्रम इस प्रकार है – HI> HBr > HCI। विभिन्न ऐल्केनॉल का हाइड्रोजन हैलाइड के प्रति क्रियाशीलता का क्रम तृतीयक द्वितीयक > प्राथमिक है। प्राथमिक और द्वितीयक ऐल्केनॉल तो HCI के साथ निर्जल ZnCl2 की उपस्थिति में क्रिया करते हैं, जबकि तृतीयक ऐल्केनॉल सान्द्र HCI से सीधे ही साधारण तापक्रम पर सुगमता से अभिक्रिया कर लेते हैं।
ऐल्कोहॉल की हाइड्रोजन हैलाइड के साथ अभिक्रिया अम्ल उत्प्रेरित होती है। ऐल्कोहॉल HCI, HBr, या HI से तो अभिक्रिया करते हैं परन्तु अम्ल की उपस्थिति के बिना NaCl, NaBr तथा Nal से अभिक्रिया नहीं करते ।
क्रिया-विधि- द्वितीयक तथा तृतीयक ऐल्कोहॉल SN क्रिया-विधि द्वारा प्रतिस्थापन अभिक्रिया करते । तृतीयक ब्यूटिल ऐल्कोहॉल की HCI के साथ अभिक्रिया की क्रिया – विधि निम्नलिखित पदों में दी जा सकती है-
प्राथमिक ऐल्कोहॉल तथा मेथिल ऐल्कोहॉल हाइड्रोजन हैलाइड के साथ S2 प्रकार की प्रतिस्थापन अभिक्रिया देते हैं- अम्ल से प्रोटॉनीकृत ऐल्कोहॉल बनता है। प्रोटॉनीकृत ऐल्कोहॉल का कार्बन-ऑक्सीजन बन्ध पूर्णतया टूटने की बजाए कमजोर हो जाता है और हैलाइड इससे एक अणु जल को प्रतिस्थापित कर देता है।
चूंकि क्लोराइड आयन ब्रोमाइड तथा आयोडाइड आयनों की अपेक्षा एक दुर्बल नाभिक स्नेही होता है। इसलिए हाइड्रोजन क्लोराइड प्राथमिक और द्वितीयक ऐल्कोहॉलों से सीधे अभिक्रिया नहीं करता। यह अभिक्रिया किसी लूइस अम्ल जैसे निर्जल क्लोराइड की उपस्थिति में होती है । सान्द्र HCl तथा निर्जल ZnCl2 के मिश्रण को लुकास अभिकर्मक कहते हैं ।
ऐल्कोहॉल की हाइड्रोजन हैलाइड के साथ अभिक्रिया की SN1 या SN2 क्रिया विधि अभिक्रिया दशाओं, से बनने वाले कार्बोनियम आयन के स्थायित्व, ऐल्कोहॉल में त्रिविम बाधा विन्यास आदि कारकों पर निर्भर करती है। साधारणतः प्राथमिक ऐल्कोहॉल में SN2 तथा तृतीयक ऐल्कोहॉल में SN1 क्रियाविधि से अभिक्रिया होती है।
(2) फॉस्फोरस हैलाइडों के साथ अभिक्रिया (Reaction with phosphorous halides) – प्राथमिक द्वितीयक ऐल्कोहॉल फॉस्फोरस हैलाइडों जैसे PI3, PBr3, PC13 तथा PCI5 आदि से अभिक्रिया करके संगत ऐल्किल हैलाइड बनाते हैं। अभिक्रिया फॉस्फोरस तथा हैलोजन के साथ भी हो सकती है। फॉस्फोरस तथा हैलोजन अभिक्रिया के समय (In situ) फॉस्फोरस हैलाइड बनाते हैं जो ऐल्कोहॉल से अभिक्रिया कर लेते हैं। तृतीयक ऐल्कोहॉल फॉस्फोरस हैलाइडों के साथ बहुत कम मात्रा में अभिक्रिया करते हैं ।
क्रिया-विधि–इसमें ऐल्कोहॉल एक नाभिक स्नेही की भांति व्यवहार करता है। यह फॉस्फोरस हैलाइड के फास्फोरस पर से हैलाइड आयन का विस्थापन कर देता है तथा प्रोटॉनीकृत ऐल्किलडाइ हैलो फॉस्फाइट बनता
अब X- आयन नाभिक स्नेही की भांति कार्य करता है और प्रोटॉनीकृत डाइहैलोफास्फाइट से HOPX2 को प्रतिस्थापित कर देता है।
यह HOPX2 ऐल्कोहॉल की अधिक मात्रा में क्रिया कर सकता है। इस प्रकार ऐल्कोहॉल के तीन अणु फास्फोरस ट्राइहैलाइड के एक अणु से अभिक्रिया करके तीन अणु ऐल्किल हैलाइड के बनाते हैं।
3R—CH2OH + PX3 → 3RCH2X + H2PO3
(3) थायोनिल क्लोराइड के साथ अभिक्रिया (Reaction with thionyl chloride)– प्राथमिक एवं द्वितीयक ऐल्कोहॉल थायोनिल क्लोराइड के साथ अभिक्रिया करके संगत ऐल्किल क्लोराइड बनाते हैं। अभिक्रिया की दर तृतीयक ऐमीन की उपस्थिति में बहुत अधिक बढ़ जाती है अर्थात् ऐल्किल क्लोराइड अधिक मात्रा में बनते हैं।
तृतीयक ऐमीन R3N अभिक्रिया में बने HCI के साथ अभिक्रिया कर लेती है।
R3N: + HCl →R3NH+ + Cr
क्रिया-विधि- अभिक्रिया में प्रारम्भ में ऐल्किल क्लोरो सल्फाइट बनता |
इस ऐल्किल क्लोरोसल्फाइट से क्लोराइड आयन (जो R3N + HCI R3 NH + + CI से प्राप्त होता है) –OSOCI समूह को SN2 प्रतिस्थापन द्वारा प्रतिस्थापित कर देता है। यह —OSOCI समूह SO2 गैस तथा CI- आयन में विघटित हो जाता है।
यदि अभिक्रिया में तृतीयक ऐमीन प्रयुक्त नहीं करे तो द्वितीयक ऐल्कोहॉल की थायोनिल क्लोराइड से निम्न प्रकार अभिक्रिया हो जाती है।
(4) निर्जलीकरण (Dehydration)-
(i) ऐल्कीनों का बनना – ऐल्केनॉल जिनके B- कार्बन परमाणु (हाइड्रॉसी समूह वाले कार्बन परमाणु के निकटवर्ती कार्बन परमाणु) पर कम से कम एक हाइड्रोजन परमाणु उपस्थित हो तो निर्जलीकरण जैसे सान्द्र H2SO4, H3PO4, P2O5 या ऐलुमिना (Al2O3 ) आदि की उपस्थिति में उच्च ताप पर गर्म करने पर ऐल्कीन बनाते हैं।
उदाहरणार्थ- एथेनॉल सान्द्र सल्फ्यूरिक अम्ल की उपस्थिति में 100°C ताप पर गर्म करने पर एथिल हाइड्रोजन सल्फेट तथा 165-170°C पर एथीन बनाता है। इसी प्रकार एथेनॉल वाष्प 380° ताप पर तप्त ऐलुमिना पर प्रवाहित करने पर एथीन बनाती है।
ऐल्केनॉल की निर्जलीकरण की सुगमता का क्रम इस प्रकार है-
30 > 20 > 10
अभिक्रिया की क्रिया-विधि निम्न प्रकार है-
तृतीयक ऐल्कोहॉल की अपेक्षा द्वितीयक ऐल्कोहॉल और द्वितीयक ऐल्कोहॉल की अपेक्षा प्राथमिक ऐल्कोहॉल का निर्जलीकरण उच्च तापक्रम पर होता है।
ऐल्कोहॉल निर्जलीकरण के कुछ विशिष्ट उदाहरण निम्न प्रकार हैं-
(a) 2-मेथिल – 2- ब्यूटेनॉल से 2 – मेथिल – 1ब्यूटीन की अपेक्षा 2 मेथिल – 2- ब्यूटीन मुख्य मात्रा में बनता हैं
(b) 2,2- डाइमेथिल प्रोपेनॉल से भी 2 – मेथिल – 2- ब्यूटीन प्राप्त होता है क्योंकि अभिक्रिया के समय बना कार्बोनियम आयन अधिक स्थायी कार्बोनियम आयन में पुनर्विन्यसित हो जाता है।
(iii) 1-ब्यूटेनॉल और 2- ब्यूटेनॉल से विपक्ष – 2 – ब्यूटीन मुख्य उत्पाद के रूप में प्राप्त होता है।
(ii) ईथर का बनना — प्राथमिक ऐल्कोहॉल के निर्जलीकरण से ईथर भी बनाये जा सकते हैं। ईथर प्राप्त करने के लिए निर्जलीकरण ऐल्कोहॉल की अधिकता तथा ऐल्कीन बनने की अपेक्षा कम ताप पर किया जाता है। उदाहरणार्थ, एथिल ऐल्कोहॉल के 140°C पर निर्जलीकरण से डाइएथिल ईथर और 165- 170°C पर एथीन प्राप्त होती है।
ईथर के बनने में SN2 क्रियाविधि प्रयुक्त होती है जिसमें ऐल्कोहॉल का एक अणु नाभिक स्नेही का कार्य करता है।
ऐल्कोहॉल की वे अभिक्रियाऐं जिनमें RO – H बन्ध टूटता है (Reactions of alcohols involving RO – H bond fission)
(1) ऐल्कोहॉल की अम्लीय प्रकृतिः धातुओं से अभिक्रिया (Acidic nature of alcohols : Reaction with metals) – ऐल्कोहॉल अति दुर्बल अम्ल होते हैं। अधिकतर ऐल्कोहॉलों के अम्लीयता स्थिरांक (Ka) की कोटि 10-18 होती है। जल का अम्लीयता स्थिरांक (Ka) का मान 10-16 होता है। अतः ऐल्कोहॉल जल की अपेक्षा दुर्बल अम्ल हैं। ये टर्मिनल ऐल्काइनों (Ka = 10-25 ) तथा अमोनिया (Ka = 10-34) की अपेक्षा प्रबल अम्ल की भांति व्यवहार करते हैं।
ऐल्कोहॉल सक्रिय धातुओं जैसे सोडियम तथा पोटैशियम या सोडियम हाइड्रॉक्साइड से अभिक्रिया करने पर ऐल्कॉक्साइड बनाते हैं ।
चूँकि अमोनिया ऐल्कोहॉल की अपेक्षा अति दुर्बल अम्ल है अत: ऐमाइड आयन (NH2 ) ऐल्कॉक्साइड आयन (OR) की अपेक्षा अति प्रबल क्षार होगा । यदि ऐल्कोहॉल की अभिक्रिया सोडामाइड (NaNH2) के साथ द्रव NH3 के करें तो अभिक्रिया के फलस्वरूप सोडियम ऐल्कॉक्साइड और अमोनिया बनेंगे।
ROH + NaNH2 → RONà + NH3
ऐल्कोहॉलों की आपेक्षिक अम्लीयता का क्रम निम्न प्रकार है-
तृतीयक द्वितीयक < प्राथमिक < मेथेनॉल
तृतीयक ब्यूटिल ऐल्कोहॉल मेथेनॉल की अपेक्षा कम अम्लीय है । अतः तृतीयक ब्यूटॉक्साइड आयन मेथॉक्साइड आयन की अपेक्षा प्रबल क्षार होगा ।
स्पष्टीकरण- चूंकि ऐल्किल समूह का + I प्रभाव होता है अतः प्राथमिक से तृतीयक ऐल्कोहॉल की ओर जाने पर C–0 बंध के इलेक्ट्रॉनों का ऑक्सीजन परमाणु विस्थापन अधिक होगा। इसको निम्न प्रकार प्रदर्शित कर सकते हैं।
इस प्रकार O-परमाणु पर ऋण आवेश बढ़ने पर O – H बंध का आयनन कम होगा और O-H बंध से H+ (प्रोटोन) के पृथक्करण की सुगमता घटेगी इसलिये ही ऐल्कोहॉल की अम्लीयता का क्रम
p > s > t है।
यदि B-प्रतिस्थापित ऐल्कोहॉलों पर विचार करें तो प्रतिस्थापी समूह का – I प्रभाव बढ़ने पर ऐल्कोहॉल का अम्लीय गुण बढ़ता है क्योंकि C–0 बंध के ऑक्सीजन पर इलेक्ट्रॉन घनत्व कम हो जाता है जिससे O—H बंध के इलेक्ट्रॉनों का O – परमाणु की ओर विस्थान बढ़ जाता है जिससे प्रोटॉन की उपलब्धता बढ़ जाती है।
ऐल्कोहॉल ग्रीन्यार अभिकर्मक के साथ भी अम्लीय प्रकृति प्रदर्शित करते हैं। ग्रीन्यार अभिकर्मक, C – Mg बंध की ध्रुवीय प्रकृति के कारण कार्बेनियन की भांति व्यवहार करते हैं।
ROH + R’MgX → R’H + ROMgX
(i) ऐल्कोहॉल की कार्बोक्सिलिक अम्ल के साथ खनिज अम्ल सांद्र H2SO4 या सांद्र HCI की उपस्थिति में अभिक्रिया से एस्टर बनते हैं। इस अभिक्रिया को एस्टरीकरण (Esterification) कहते हैं। साधारणतया अभिक्रिया फिशर एस्टरीकरण कहलाती है।
विभिन्न प्रकार के ऐल्कोहॉलों से एस्टर बनने का सुगमता क्रम निम्न प्रकार है-
मेथेनॉल > प्राथमिक > द्वितीयक तृतीयक ऐल्कोहॉल
अभिक्रिया की क्रिया – विधि को निम्न प्रकार दिया जा सकता है-
विपरीत अभिक्रिया एस्टर के अम्ल उत्प्रेरित जल अपघटन की क्रिया – विधि को प्रदर्शित करती है। (ii) ऐसिलीकरण- ऐल्कोहॉलों की ऐसिल हैलाइडों अथवा अम्ल ऐनहाइड्राइडों से अभिक्रिया पर भी एस्टर बनते हैं। यह अभिक्रिया ऐसिलीकरण कहलाती है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics