Halo acids in chemistry hindi examples हैलो अम्ल किसे कहते हैं उदाहरण सहित समझाइये
हैलो अम्ल किसे कहते हैं उदाहरण सहित समझाइये Halo acids in chemistry hindi examples ?
ऐक्रिलिक अम्ल (2- प्रोपीनोइक अम्ल)
असंतृप्त अम्ल बनाने की सामान्य विधियों के अतिरिक्त इसका औद्योगिक संश्लेषण निम्न प्रकार किया जा सकता है
क्रोटोनिक अम्ल तथा आइसोक्रोटोनिक अम्ल (CH 3 – CH= CH-COOH)-
क्रोटोनिक अम्ल तथा आइसोक्रोटोनिक अम्ल एक-दूसरे के ज्यामिति समावयवी हैं। दोनों ही 2- ब्यूटीनोइक अम्ल है। क्रोटोनिक अम्ल विपक्ष (Trans) समावयवी है जबकि आइसोक्रोटोनिक अम्ल समपक्ष (Cis) अमावयवी है। इनकी संरचनाओं का निम्न प्रकार प्रदर्शित कर सकते हैं।
क्रोटोनिक अम्ल आइसोक्रोटोनिक अम्ल की अपेक्षा अधिक स्थायी है। क्रोटोनिक अम्ल को 100°C ताप पर गर्म करने पर यह आइसोक्रोटोनिक अम्ल में बदल जाता है ।
क्रोटोनिक अम्ल को निम्नलिखित विधियों द्वारा बनाया जा सकता है-
(i) β-हाइड्रॉक्सी ब्यूटिरिक अम्ल को NaOH के साथ गर्म करने पर –
(ii) मैलोनिक एस्टर की ऐसीटैल्डिहाइड के साथ अभिक्रिया द्वारा – (नोवेनैजेल अभिक्रिया)
(iii) क्रोटोनऐल्डिहाइड का अमोनियामय सिल्वर नाइट्रेट के द्वारा ऑक्सीकरण करने पर –
आइसोक्रोटोनिक अम्ल – एथिल ऐसीटोऐसीटेट की फॉस्फोरस पेंटाक्लोराइड के साथ अभिक्रिया से J- क्लोरो आइसोक्रोटोनिक एस्टर प्राप्त होता है। β- क्लोरो आइसोक्रोटोनिक एस्टर की सोडियम अमलगम (Na-Hg) के साथ अभिक्रिया से आइसोक्रोटोनिक अम्ल बनता है।
प्रोपिऑलिक अम्ल या प्रोपार्जिलिक अम्ल या 2- प्रोपाइनोइक अम्ल –
यह सरलतम ऐसिटिलिनिक कार्बोक्सिलिक अम्ल है। इसे सोडियम ऐसीटिलाइड पर शुष्क CO2
की अभिक्रिया से बनाया जा सकता है।
अभिक्रियाऐं – (i) सोडियम अम्लगम से अपचयन पर यह प्रोपेनोइक अम्ल देता है।
(ii) हैलोजन अम्लों के साथ अभिक्रिया करके β- हैलोजन ऐक्रिलिक अम्ल देता है।
(iii) यह अमोनिकल सिल्वर नाइट्रेट के साथ सिल्वर लवण और अमोनिकल क्यूप्रस क्लोराइड के साथ क्यूप्रस लवण बनता है।
(iv) सूर्य के प्रकाश के सम्पर्क में यह बहुलकीकृत होकर ट्राइमेसिक अम्ल (बेंजीन – 1,3,5- ट्राइकार्बोक्सिलिक अम्ल) बनाता है।
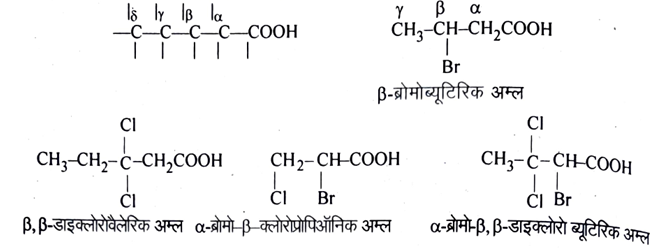
हैलो अम्ल (Halo acids)
ये ऐलिफैटिक मोनोकार्बोक्सिलिक अम्लों के व्युत्पन्न होते हैं जिन्हें कार्बोक्सिलिक समूह से जुड़े ऐल्किल समूह के एक या अधिक H – परमाणुओं को हैलोजन परमाणु (X = CI, Br या I) के द्वारा प्रतिस्थापन से प्राप्त किया जाता है।
नामकरण की रूढ पद्धति में इन्हें संगत अम्लों का हैलोजन व्युत्पन्न माना जाता है। अम्ल के ऐल्किल समूहों के C-परमाणुओं को α β γ तथा δ आदि ग्रीक अक्षरों से सम्बोधित किया जाता है। अम्ल के से पूर्व हैलोजन प्रतिस्थापी की स्थिति इन्हीं अक्षरों से दर्शाते हैं।
IUPAC पद्धति के अनुसार इन्हें हैलोऐल्केनोइक अम्ल कहते हैं। – COOH समूह परमाणु को संख्या-1 दी जाती है। श्रृंखला पर उपस्थित हैलोजन परमाणुओं को ऐल्केनोइक अम्ल से पूर्व उनकी स्थिति दर्शाते हुए अंग्रेजी वर्णमाला के क्रम में पूर्वलग्नित कर देते हैं। उदाहरणार्थ-
बनाने की विधियाँ (Methods of formation)
(1) प्रत्यक्ष हैलोजनीकरण – सूर्य के प्रकाश और हैलोजन वाहक (P, I, Fe) की उपस्थिति में उबलते हुए मोनोकार्बोक्सिलिक अम्ल में Cl2 या Br2 प्रवाहित करने पर संगत α-क्लोरो या α-ब्रोमो मोनो कार्बोक्सिलिक अम्ल प्राप्त होते हैं। सभी α-H परमाणुओं का X – परमाणु द्वारा प्रतिस्थापन हो जाता है।
प्रतिस्थापित आयोडो व्युत्पन्न बनाने के लिये संगत क्लोरो या ब्रोमो अम्ल की अभिक्रिया KI से करते
साधारण अभिक्रिया फॉस्फोरस की उपस्थिति में सुगमता से हो जाती है। इसे हैलवोल्हार्ड जेलें स्की (Hell Volhard Zelinsky) अभिक्रिया कहते हैं।
अम्ल की α–स्थिति पर क्लोरीनीकरण SO2CI2 से भी कर सकते हैं। I2 की थोड़ी सी मात्रा उत्प्रेरक के रूप लेते हैं।
(2) हाइड्रॉक्सी अम्लों से- α β γ δ- हाइड्रॉक्सी अम्ल को (P + X 2 ) या PX3 या PX5 के साथ गर्म करने पर संगत हैलो अम्ल हैलाइड प्राप्त हो जाते हैं जो जल अपघटन पर हैलो अम्ल देते हैं। उदाहरणार्थ-
(iii) हाइड्रॉक्सी अम्लों को हाइड्रोजन हैलाइड के साथ गर्म करने पर भी हैलो अम्ल बनते हैं ।
(3) ऐमीनों अम्लों से – a, By या 8- ऐमीनो अम्लों की नाइट्रोसिल क्लोराइड (टिल्डन अभिकर्मक) के साथ अभिक्रिया से संगत क्लोरो अम्ल प्राप्त होते हैं।
इसी प्रकार NOBr सं संगत ब्रोमो अम्ल प्राप्त होते हैं।
(4) सायनोहाइड्रिन से सायनोहाइड्रिन को 40% HBr के साथ गर्म करने पर भी ब्रोमो अम्ल प्राप्त होते हैं।
(5) क्लोरोहाइड्रिन का सांद्र नाइट्रिक अम्ल से ऑक्सीकरण करने पर क्लोरो अम्ल बनते है।
रासायनिक अभिक्रियाऐं
हैलो अम्ल – COOH एवं ऐल्किल हैलाइड दोनों प्रकार की अभिक्रियाऐं देते हैं।
(1)-COOH समूह की अभिक्रियाऐं – – COOH समूह के कारण ये लवण, एस्टर, अम्ल हैलाइड, अम्लऐमाइड आदि बनाते हैं।
(i) लवण का बनाना- ये धातुओं के साथ संगत लवण बना लेते हैं। उदाहरणार्थ-
(ii) क्षार विलयन के साथ हैलोजन अम्ल की अभिक्रिया अम्ल में हैलोजन परमाणु की स्थिति पर निर्भर करती है।
(a) Q- हैलो अम्ल का क्षार विलयन से जल अपघटन होकर a-हाइड्रॉक्सी अम्ल बनते हैं।
(b) B-हैलो अम्ल का क्षार विलयन से जल अपघटन होकर 3- हाइड्रॉक्सी अम्ल बनते हैं जो क्षार विलयन के साथ थोड़ी देर उबलने पर a, B-असंतृप्त अम्ल बनाते है।
(c) Y- एवं 8- हैलो अम्लों को NaOH के साथ गर्म करने पर संगत – एवं 8 – लैक्टोन बनते हैं।
(iii) एस्टरीकरण- ये ऐल्कोहॉल के साथ अभिक्रिया करके संगत एस्टर बनाते हैं।
(2) हैलोजन परमाणु के कारण अभिक्रिया – हैलो अम्लों में हैलोजन परमाणु को – OH, CN, NH2, NO2 आदि समूहों के द्वारा प्रतिस्थापित किया जा सकता है-
(v) क्लोरोऐसीटिक अम्ल सिल्वर के साथ गर्म करने पर सक्सिनिक अम्ल बनाता है।
(vi) डाइक्लोरोऐसीटिक अम्ल को NaOH के साथ गर्म करने पर ग्लाइऑक्सेलिक अम्ल बनता है।
एक क्षारकी हाइड्रॉक्सी अम्ल (Monbasic Hydrory Acids)
एक-क्षारकी अम्ल के ऐल्किल समूह से एक हाइड्रोजन परमाणु को हाइड्रॉक्सी समूह के द्वारा प्रतिस्थापित करने पर एक- क्षारकी हाइड्रॉक्सी अम्ल प्राप्त होते हैं।
नामकरण- नामकरण की रूढ़ पद्धति में इन्हें संगत अम्लों का हाइड्रॉक्सी व्युत्पन्न माना जाता है। अम्ल के ऐल्किल समूहों के कार्बन परमाणुओं को a, By तथा 8 आदि ग्रीक अक्षरों से सम्बोधित किया जाता है। अम्ल के नाम से पूर्व हाइड्रॉक्सी समूह की स्थिति को इन्हीं अक्षरों से दर्शाते हैं।
IUPAC पद्धति के अनुसार इन्हें हाइड्रॉक्सी ऐल्केनोइक अम्ल कहते हैं । —COOH समूह के C परमाणु को संख्या 1 दी जाती है। श्रृंखला पर हाइड्रॉक्सी समूह की स्थिति को निम्न प्रकार दर्शाते हैं-
यदि द्विक्षारकी अम्ल में उपस्थित मेथिलीन समूहों के विभिन्न C – परमाणुओं से एक या अधिक H- परमाणु को हाइड्रॉक्सी समूहों के द्वारा प्रतिस्थापित करें तो द्विक्षारकी हाइड्रॉक्सी अम्ल प्राप्त होते हैं। उदाहरणार्थ-
सिट्रिक अम्ल एक त्रिक्षारकी हाइड्रॉक्सी अम्ल है।
बनाने विधियाँ— हाइड्रॉक्सी अम्लों के बनाने की विधियाँ श्रृंखला पर हाइड्रॉक्सी समूह की स्थिति पर निर्भर करती हैं। इनके बनाने की कुछ सामान्य विधियाँ निम्न प्रकार हैं-
(1) हैलोजन प्रतिस्थापी अम्लों से- हैलोजन प्रतिस्थापी अम्लों को नम सिल्वर ऑक्साइड अथवा तनु क्षारों अथवा सोडियम कार्बोनेट विलयन के साथ उबालने पर हाइड्रॉक्सी अम्ल प्राप्त होते हैं।
इस विधि से -हाइड्रॉक्सी अम्लों की लब्धि तो अधिक मात्रा में प्राप्त होती है परन्तु B,y तथा c हाइड्रॉक्सी अम्लों की लब्धि बहुत कम प्राप्त होती है।
(2) ऐमीनो अम्लों से – ऐमीनों अम्लों की नाइट्रस अम्ल होते हैं। अभिक्रिया पर भी हाइड्रॉक्सी अम्ल प्राप्त
इस विधि से भी अपेक्षाकृत a – हाइड्रॉक्सी अम्ल ही अधिक मात्रा में बनते हैं।
(3) ऐल्डिहाइड तथा कीटोनिक अम्लों के अपचयन से-ऐल्डिहाइड तथा कीटोनिक अम्लों के अपचयन से भी हाइड्रॉक्सी अम्ल प्राप्त होते हैं।
(4) कीटोएस्टर के उत्प्रेरित अपचयन से – ap,y तथा 8- हाइड्रॉक्सी अम्लों का संगत कीटो एस्टर के उत्प्रेरित अपयचन से बनाया जाता है।
(5) रिफॉरमेट्स्की अभिक्रिया से (From Reformatsky reaction ) — a- हैलोजन एस्टर की जिंक की उपस्थिति में ऐल्डिहाइड, कीटोन अथवा एस्टर से अभिक्रिया करने पर 3-हाइड्रॉक्सी एस्टर प्राप्त होते हैं जो जल अपघटन पर – हाइड्रॉक्सी अम्ल बनाते हैं।
(6) ऐल्डिहाइड तथा कीटोनों के सायानोहाइड्रिन से- ऐल्डिहाइड तथा कीटोन के सायनोहानि अम्लीय अथवा क्षारकीय जल अपघटन द्वारा a-हाइड्रॉक्सी अम्ल बनाते हैं ।
(7) ऐल्डॉलों के ऑक्सीकरण से – ऐल्डॉल के टॉलेन अभिकर्मक द्वारा ऑक्सीकरण से हाइड्रॉक्सी अम्ल प्राप्त होते हैं।
(8) ग्लाइकॉल के ऑक्सीकरण से ग्लाइकॉलों के तनु HNO3 द्वारा नियन्त्रित ऑक्सीकरण से भी हाइड्रॉक्सी अम्ल बनते हैं।
(9) ऐसे वसा अम्ल जिनमें > CH-COOH समूह होता है, नाइट्रिक अम्ल अथवा अम्लीय KMnO, सापे द्वारा ऑक्सीकरण पर हाइड्रॉक्सी अम्ल बनाते हैं ।
सामान्य रासायनिक अभिक्रियायें – हाइड्रॉक्सी अम्ल, अम्लों तथा ऐल्कोहॉलों दोनों की भांति व्यवहार करते हैं। ये –OH (ऐल्कोहॉलिक) तथा – COOH (कार्बोक्सिल) समूह की सामान्य अभिक्रियायें देते हैं। बहुत सी अभिक्रियाओं में कार्बोक्सिलिक समूह तथा ऐल्कोहॉलिक समूह एक-दूसरे की अभिक्रियाओं में व्यवधान नहीं डालते। कार्बोक्सिलिक समूह का एस्टरीकरण कर देने के बाद ये मुख्यतः हाइड्रॉक्सी यौगिकों की तरह ही व्यवहार करते हैं।
(1) कार्बोक्सिलिक समूह को एस्टर, ऐमाइड, नाइट्राइल तथा ऐसिल क्लोराइड आदि में परिवर्तित किया जा सकता है। हाइड्रॉक्सिल समूह (कार्बोक्सिल समूह को एस्टर में बदलने के बाद) को एस्टर, ईथर आदि में बदला जा सकता है।
ग्लाइकॉलिक अम्ल की ऐसीटिल क्लोराइड से अभिक्रिया पर ऐसीटिल ग्लाइकॉलिक अम्ल बनता है (हाइड्रॉक्सी समूह की अभिक्रिया)
ग्लाइकॉलिक अम्ल PCI5 या थायोनिल क्लोराइड से अभिक्रिया करके क्लारोऐसीटिल क्लोराइड नाता है। (-OH तथा – COOH दोनों की अभिक्रियायें)।
(2) अम्लीय पोटैशियम परमैगनेट से अभिक्रिया करने पर ये ऐल्डिहाइड तथा कीटोन में बदल जाते.
(3) हाइड्रॉक्सी अम्लों का हाइड्रोजन आयोडाइड के द्वारा अपचयन पर संगत अम्ल बनते हैं। RCH COOH + 2HIRCH,
हाइड्रॉक्सी अम्लों पर ताप का प्रभाव-
हाइड्रॉक्सी अम्लों के गर्म करने पर बनने वाला उत्पाद हाइड्रॉक्सिल तथा कार्बोक्सिल समूहों की सापेक्ष स्थितियों पर निर्भर करता है।
(i) a हाइड्रॉक्सी अम्ल – हाइड्रॉक्सी अम्लों को गर्म करने पर लैक्टाइड बनते हैं। लैक्टाइड छः सदस्यीय वलय यौगिक होते हैं – हाइड्रॉक्सी अम्ल के दो अणु प्रयुक्त होते हैं।
(ii) B-हाइड्रॉक्सी अम्ल— B–हाइड्रॉक्सी अम्लों को गर्म करने पर मुख्यतः a, p-असंतृप्त : बनते हैं और जल का अणु निकलता है।
(iii) y- तथा 8-हाइड्रॉक्सी अम्ल – y- तथा 8- हाइड्रॉक्सी अम्लों को गर्म करने पर उनके एक ही अणु के हाइड्रॉक्सिल तथा कार्बोक्सिल समूहों से निर्जलीकरण द्वारा चक्रीय आंतरिक एस्टर बनते है। Y–हाइड्रॉक्सी अम्ल से पाँच सदस्यीय आंतरिक एस्टर बनते हैं जिन्हें – लैक्टोन कहते हैं। 8- हाइड्रॉक्सी अम्लों से 8- लैक्टोन बनते हैं जो छः सदस्यीय आंतरिक एस्टर होते हैं।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics