Gas Ion Electrodes in hindi गैस आयन इलेक्ट्रोड किसे कहते हैं प्रकार क्या है उदाहरण लिखिए
गैस आयन इलेक्ट्रोड किसे कहते हैं प्रकार क्या है उदाहरण लिखिए
मानक इलेक्ट्रोड विभव (Standard Electrode Potential)
इलेक्ट्रोड विभव विलयन में उपस्थित आयनों की सान्द्रता पर भी निर्भर करते हैं, परन्तु इलेक्ट्रोड विभव का मान प्रत्येक संभव सान्द्रता पर ज्ञात करना कठिन कार्य है। अतः मानक हाइड्रोजन विभव के सन्दर्भ में विद्युत अपघटय की मानक अवस्था (Standard State) में इलेक्ट्रोड विभव ज्ञात किये जाते हैं, जिन्हें मानक इलेक्ट्रोड विभव कहते हैं। निम्नलिखित उदाहरण से यह और भी स्पष्टतः समझा जा सकता है।
माना कि एक Zn की छड़ ZnSO4 के विलयन में है। अतः इलेक्ट्रोड Zn | Zn 2+ होगा।
नेट समीकरण का उपयोग करके इलेक्ट्रोड विभव निम्न प्रकार से व्यक्त किया जा सकता है-
यह्यं E(zn2+Zn) मानक इलेक्ट्रोड विभव है, इसे निम्न प्रकार परिभाषित किया जा सकता है-
Zn छड़ पर उत्पन हुआ वह विभव जबकि Zn छड़ इकाई सक्रियता के Zn2+ के सम्पर्क में हो, Za का मानक इलेक्ट्रोड विभव कहलाता है।
नेर्न्स्ट समीकरण का उपयोग करके किसी भी इलेक्ट्रोड के इलेक्ट्रोड विभव का मान लिखा जा सकता है।
सारणी 5.2 में कुछ इलेक्ट्रोडों के मानक इलेक्ट्रोड विभव बढ़ते हुये क्रम में दिये गये हैं।
विद्युत रासायनिक श्रेणी मानक इलेक्ट्रोड विभव (Electro Chemical Series Electromotive Series: Standard Electrode Potential)
समीकरण (22) से यह स्पष्ट है कि जब ऑक्सीकृत तथा अपचयित अवस्थाऐं एक सक्रियता पर हो तो इलेक्ट्रोड विभव Eel मानक इलेक्ट्रोड विभव E°el के बराबर होता है। यदि कोई इलेक्ट्रोडअर्ध सेल क्रिया में इलेक्ट्रॉन त्यागता है तो उसका विभव ऑक्सीकरण विभव ( oxidation potential) होगा तथा यदि अर्ध सेल क्रिया के इलेक्ट्रॉड द्वारा इलेक्ट्रॉन को ग्रहण किया जा रहा हो तो उत्पन्न विभव अपचयन विभव (Reduction Potential) कहलाता है। मानक हाइड्रोजन इलेक्ट्रोड (SHE) की तुलना में विभिन्न तत्वों के इलेक्ट्रोड विभव ज्ञात किये गए जिन्हें मानक इलेक्ट्रोड विभव (Standared electrode Potential) कहते हैं। इनको हाइड्रोजन स्केल पर लिए गए मानक विभवों को एक व्यवस्थित रूप में जमाने पर प्राप्त होने वाली श्रेणी को विद्युत रासायनिक श्रेणी या विद्युत श्रेणी या सक्रियता श्रेणी कहते हैं। अन्तर्राष्ट्रीय स्तर पर यह निर्णय किया गया कि इलेक्ट्रोड विभव के मान सदैव अपचयन विभव के रूप में लिखे जाते हैं। अतः विद्युत रासायनिक श्रेणी में अपचयन विभव (Reduction Potential) मान उनके बढ़ते हुए मानों के आधार पर व्यवस्थित कर श्रेणी बनाई गई है मानक स्थितियों में विभिन्न तत्वों के E° के मान स्थिर होते हैं अतः मानक इलेक्ट्रोड विभव इलेक्ट्रोड के तत्व का निश्चित el है । 298K पर कुछ इलेक्ट्रोड़ों के मानक अपचयन विभव उनकी अपचयन क्रिया के साथ सारणी 6.2 में दिये गये हैं।
सारणी 6.2 : वैद्युत रासायनिक श्रेणी (Electrochemical Series) [25°C पर मानक इलेक्ट्रोड विभव (अपचयन) Reduction]
विद्युत रासायनिक श्रेणी की विशेषताऐं (Characteristics of Electro- Chemical Series)
- जो पदार्थ हाइड्रोजन से अधिक प्रबल अपचायक होते हैं वे पदार्थ श्रेणी में हाइड्रोजन से ऊपर स्थित होते हैं और उनके मानक अपचयन विभव के मान ऋणात्मक होते हैं जिनके E° का मान जितना अधिक ऋणात्मक होगा वह उतना ही अधिक प्रबल अपचायक होगा।
- जबकि हाइड्रोजन से कम प्रबल अपचायक पदार्थ श्रेणी में हाइड्रोजन से नीचे होते है और उनके E° का मान धनात्मक होते हैं।
(3) विद्युत रासायनिक श्रेणी में धातुओं की अपचयन क्षमता ऊपर से नीचे की ओर जाने पर घटती जाती है।
(4) विद्युत रासायनिक श्रेणी में ऊपर से नीचे की ओर जाने पर धातुओं पर धन विद्युती लक्षण घटता जाता है।
(5) श्रेणी में ऊपर से नीचे की ओर जाने पर पदार्थों की ऑक्सीकरण क्षमता बढ़ती जाती है।
(6) विद्युत रासायनिक श्रेणी में ऊपर से नीचे की ओर जाने पर तत्वों का ऋण विद्युती लक्षण बढ़ता जाता है।
(7) श्रेणी में ऊपर से नीचे की ओर जाने पर अधातुओं की क्रियाशीलता बढ़ती जाती है।
विद्युत रासायनिक श्रेणी या मानक इलेक्ट्रोड विभव के अनुप्रयोग या सार्थकता. (Applications or Singificance of Electro Chemical Series)
(I) पदार्थ जो इलेक्ट्रॉन ग्रहण करके मानक इलेक्ट्रोड विभव (E°) का न्यूनतम मान प्रदर्शित करता है वह पदार्थ प्रबलतम अपचायक होगा। जो पदार्थ इलेक्ट्रॉन ग्रहण करके मानक विभव (E) का अधिकतम मान प्रदर्शित करता है वह पदार्थ सबसे प्रबल ऑक्सीकारक होगा। श्रेणी में इस आधार पर लीथियम सबसे प्रबल अपचायक पदार्थ हैं जबकि फ्लुओरीन सबसे प्रबल ऑक्सीकारक पदार्थ है ।
(2) सारणी 6.2 के आधार पर लीथियम उच्चतम धन विद्युती गुण प्रदर्शित करते हैं जबकि फ्लुओरीन निम्नतम धन विद्युती गुण प्रदर्शित करता है।
(3) तत्वों का विस्थापन विद्युत रासायनिक श्रेणी में ऊपर विद्यमान तत्व अपने से नीचे स्थित सभी धातु आयनों को उनके विलयनों से विस्थापित करके उन्हें धातु के रूप मे अवक्षेपित कर देते हैं।
उदाहरणार्थ- जिंक धातु कॉपर सल्फेट विलयन में डालने पर कॉपर अवक्षेपित हो जाऐगा।
Zn(s) + CuSO4 ZnSO4 + Cu(s)
जबकि CuSO4 विलयन में लोहे की कील डालने पर लोहे की कील तांबे जैसी लाल हो जायेगी और CuSO4 का नीला विलयन हरे रंग का हो जायेगा।
CuSO4 + Fe ⇒ FeSO4 + Cu
नीला हरा
इसके विपरीत अधातु तत्व जो श्रेणी में नीचे होगा वह आसानी से इलेक्ट्रॉन ग्रहण करेगा और अपने से ऊपर विद्यमान तत्वों को उनके विलयनों से विस्थापित करेगा। अतः ब्रोमीन आयोडीन को और क्लोरीन ब्रोमीन व आयोडीन दोनों को विस्थापित कर देता है अर्थात्
(4) अम्लों में से धातुओं द्वारा हाइड्रोजन गैस मुक्त होना- जिस तत्व का मानक विभव का मान अधिक ऋणात्मक होगा उस तत्व की तनु अम्लों से हाइड्रोजन गैस मुक्त करने की प्रकृति उतनी ही अधिक होगी यह कारण है कि Na, Mg Zn आदि तत्व तनु अम्लों से क्रिया करके (यहाँ तक की जल से) हाइड्रोजन गैस देते हैं परन्तु Cu, Ag. Fe आदि तत्व तनु अम्लों के साथ अभिक्रिया करके हाइड्रोजन गैस नहीं देते।
(5) किसी सेल का मानक वि.वा.बल ज्ञात करना-
(6) रेडाक्स अभिक्रिया के सम्पन्न होने की सम्भावना – यह तभी सम्भव होगी जब दो इलेक्ट्रोडों से बने सेल के वि.वा. बल का मान धनात्मक हो ।
6.15 विभिन्न प्रकार के इलेक्ट्रोड (Types of Electrods)
जैसा कि पूर्व में बताया गया है, प्रत्येक सेल दो इलेक्ट्रोडों से मिल कर बनता हैं विभिन्न प्रकार के प्रमुख इलेक्ट्रोड, उनकी इलेक्ट्रोड (अर्द्धसेल) अभिक्रिया तथा इलेक्ट्रोड विभव के लिये नेट समीकरण आदि का वर्णन अधोलिखित पैराग्राफ में किया गया है।
प्रमुख इलेक्ट्रोड़ों को निम्नलिखित चार भागों में बांटा गया है।
गैस आयन इलेक्ट्रोड (Gas Ion Electrodes):-
गैस इलेक्ट्रोडों में प्लेटिनम अथवा ग्रेफाइट को चालक के रूप में उपयोग किया जाता है, तथा गैस के साथ उसके धनायन अथवा ऋणायन सम्पर्क में होते हैं। मुख्यतः निम्नलिखित इलेक्ट्रोड उपयोग में आते हैं।
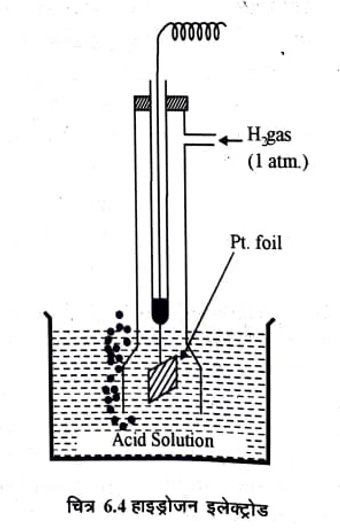
(a) हाइड्रोजन इलेक्ट्रोड (Hydrogen Electrode ) : H2 गैस को HCl अथवा किसी अन्य अम्ल के विलयन में 1 वायुमण्डलीय दाब पर प्रवाहित किया जाता है जिसमें Pt का इलेक्ट्रोड डूबा रहता हैं इसका आलेख निम्न हैं-
हाइड्रोजन इलेक्ट्रोड में साधारणता एक प्लेटिनम का पत्र (foil) होता है, जिस पर Pt ब्लेक की परत चढ़ी होती है। यह पत्र अम्ल के विलयन में डूबा रहता है। एक सरल हाइड्रोजन इलेक्ट्रोड चित्र 6.4 में दिखाया गया है।
एक वायुमण्डलीय दाब पर इस विलयन H गैस प्रवाहित की जाती है। हाइड्रोजन गैस पूर्ण रूप से Pt पत्र पर अधिशोषित हो जाती है। अतः Pt पत्र पर H2 का दाब 1 वायुमण्डल ही रहता है। इस प्रकार Pt पत्र की H2 गैस तथा विलयन के H+ के मध्य साम्यावस्था स्थापित हो जाती है।
यदि विलयन में उपस्थित H+ की सक्रियता इकाई हो तो हाइड्रोजन इलेक्ट्रोड मानक हाइड्रोजन इलेक्ट्रोड (Standard Hydrogen Electord – SHE) कहलाता है। इस अवस्था में इसका विभव शून्य माना गया है।
(b) क्लोरीन इलेक्ट्रोड (Chlorine Electrode ) :- इस इलेक्ट्रोड में एक निश्चित दाब पर CI2 गैस HCI के विलयन में प्रवाहित की जाती है। इसका आरेख निम्न प्रकार लिखा जाता है’
(c) ऑक्सीजन इलेक्ट्रोड (Oxygen Electrode ) :- इलेक्ट्रोड में एक निश्चित दाब P पर O2 एक ऐसे विलयन में प्रवाहित की जाती है जिसमें OH- उपस्थित हो। इलेक्ट्रोड निम्न प्रकार लिखा जाता है।
ऑक्सीजन इलेक्ट्रोड एक उत्क्रमणीय इलेक्ट्रोड के समान व्यवहार नहीं करता क्योंकि O2 तथा OH में साम्य शीघ्र स्थापित नहीं होता ।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics