faraday’s law of electrolysis class 12 in hindi फैराडे के विद्युत अपघटन के नियम लिखिए
फैराडे के विद्युत अपघटन के नियम लिखिए faraday’s law of electrolysis class 12 in hindi ?
अध्याय वैद्युत-रसायन-I (ELECTRO CHEMISTRY-1)
वैद्युत चालक (Electro-Conductors)
वे पदार्थ जो विद्युत धारा को अपने में से होकर प्रवाहित होने देते हैं उन्हें वैद्युत के चालक (Conductors of electricity) कहते हैं जैसे- ताँबा, सिल्वर, अम्ल, क्षार तथा लवण के विलयन आदि तथा जिन पदार्थों में होकर विद्युत धारा प्रवाहित नहीं हो सकती उन्हें विद्युत अचालक (Non conductors of electricity) कहते हैं। जैसे रबड़, लकड़ी, लाख आदि ।
किसी पदार्थ में से विद्युत धारा का प्रवाहित होना वैद्युत चालकता (Electrical Conduction) कहलाती है। यह प्रक्रिया दो प्रकार से सम्पन्न होती है या वैद्युत चालक मुख्य रूप से दो प्रकार के होते हैं-
(i) धात्विक चालकता या इलेक्ट्रॉनिक चालकता (Metallic or Electronic Conductors)
(ii) इलेक्ट्रोलाइटिक चालकता या आयनिक चालकता (Electrolytic Conductors or Ionic conductors)
धात्विक चालकता या इलेक्ट्रोनिक चालकता –
वे पदार्थ जिनमें विद्युत धारा लगाये गए विभव (उच्च विभव से निम्न विभव की ओर ) पर स्वतन्त्र इलेक्ट्रॉनों के प्रवाह से प्रवाहित होती हो अर्थात् इनमें आवेश वाहक इलेक्ट्रॉन होते हैं, ये धात्विक चालक या इलेक्ट्रॉनिक चालक कहलाते हैं तथा इसे धात्विक चालकता या इलेक्ट्रॉनिक चालकता कहते हैं। इन चालकों में विद्युत धारा प्रवाह के साथ कोई रासायनिक परिवर्तन नहीं होता। उदाहरणार्थ- धातु, चाँदी, ताँबा, मिश्र धातुऐं (alloys), ग्रेफाइट, कुछ ठोस लवण जैसे Cds, CuS आदि । 5.1.2 इलेक्ट्रोलाइटिक अथवा वैद्युत अपघटनी चालकता –
वें पदार्थ जिनमें विद्युत धारा का प्रवाह आयनों की गति के कारण या आयन का विपरीत आवेशित इलेक्ट्रोड पर अभिगमन के कारण होता है अर्थात ऐसे पदार्थों में आवेश वाहक आयन होते है। ये वैद्युत अपघटनी या आयनिक चालक कहलाते हैं तथा इसे इलेक्ट्रोलाइटिक या आयनिक चालकता कहते हैं। इन चालकों में विद्युत धारा के प्रवाह के साथ रासायनिक परिवर्तन होता हैं तथा पदार्थ आयनों में अपघटित हो जाता है। अतः इन पदार्थों को विद्युत अपघट्य (Electrolyte) कहते हैं। उदाहरणार्थ-
अम्ल, क्षार, पिघले हुए लवण, लवणों के जलीय विलयन आदि लेकिन कई पदार्थ विद्युत के चालक नहीं होते हैं उन्हें विद्युत अनपघट्य (Non-Electrolytes) कहते हैं जैसे-शक्कर, शुद्ध पानी आदि । लेकिन कुछ पदार्थ ऐसे भी हैं जिनमें विद्युत धारा का प्रवाह अंशतः इलेक्ट्रॉनिक तथा अंशतः आयनिक होता है। ऐसे पदार्थ मिश्रित चालक (Mixed Conductor) कहलाते हैं।
उदाहरणार्थ- पिघला हुआ क्यूप्रस क्लोराइड, द्रव अमोनिया में सोडियम का विलयन आदि ।
आयनिक विलयन में विद्युत धारा का प्रवाह, या वैद्युत अपघटन (Electrical current in lonic solution or Electrolysis)
वैद्युत अपटघन के रासायनिक परिवर्तन के साथ विद्युत धारा के चालन के प्रक्रम को वैद्युत अपघटन (Elctrolysis) कहते हैं ।
फैराडे के वैद्युत अपघटन के नियम (Faraday’s Law of Electrolysis) – फैराडे ने कई प्रयोगों के बाद 1834 में विद्युत धारा द्वारा विद्युत अपघटनों के अध्ययन के बारे में कुछ नियम प्रतिपादित किये। ये नियम उनके नाम से है जिसमें विद्युत अपघटन में विद्युत अपघट्य विलयन में प्रवाहित होने वाली विद्युत की मात्रा तथा इलेक्ट्रोड पर निक्षेपित होने वाली धातु अथवा अन्य पदार्थ की मात्रा के बीच एक मात्रात्मक सम्बन्ध स्थापित करते हैं। फैराडे के निष्कर्ष को निम्न दो नियमों द्वारा प्रतिपादित करते हैं। जो इस प्रकार हैं-
(1) फैराडे का प्रथम नियम (Faraday’s first law) : वैद्युत अपघटन में किसी इलेक्ट्रोड कैथोड अथवा एनोड पर मुक्त होने वाले पदार्थ की मात्रा विलयन में प्रवाहित होने वाली विद्युत की मात्रा के समानुपाती होती है।
माना की Qविद्युत प्रवाहित करने पर इलेक्ट्रोड पर w ग्राम पदार्थ मुक्त होता है अथवा घुलता है
यहां Z समानुपातिक स्थिरांक है जो एकत्रित हुए पदार्थ का विद्युत रासायनिक तुल्यांक (Electro- Chemical Equivalent) कहलाता है।
यदि 1 = 1 ऐम्पियर तथा t = 1 सैकण्ड हो तो
w =Z
इससे स्पष्ट है कि विद्युत रासायनिक तुल्यांक (Z) पदार्थ की ग्रामों में वह मात्रा है जो एक एम्पियर विद्युत धारा को एक सैकण्ड तक या एक कूलॉम विद्युत आवेश विलयन में प्रवाहित किये जाने पर इलेक्ट्रोड पर मुक्त होती है। इसकी इकाई ग्राम प्रति कूलॉम है।
(ii) फैराडे का द्वितीय नियम (Faraday’s second law) : फैराडे का द्वितीय नियम विद्युत की समान मात्रा द्वारा विभिन्न इलेक्ट्रोडों पर मुक्त होने वाले पदार्थों की मात्राओं में आधारभूत सम्बन्ध प्रदर्शित करता है। इस नियम के अनुसार जब विद्युत धारा की समान मात्रा विभिन्न विद्युत अपघट्यों में प्रवाहित की जाती है तो इलेक्ट्रोडों पर मुक्त होने वाली भिन्न-भिन्न पदार्थों की मात्राएँ उन पदार्थो के रासायनिक तुल्यांकों (Chemical Equivalants) के समानुपाती होती है।
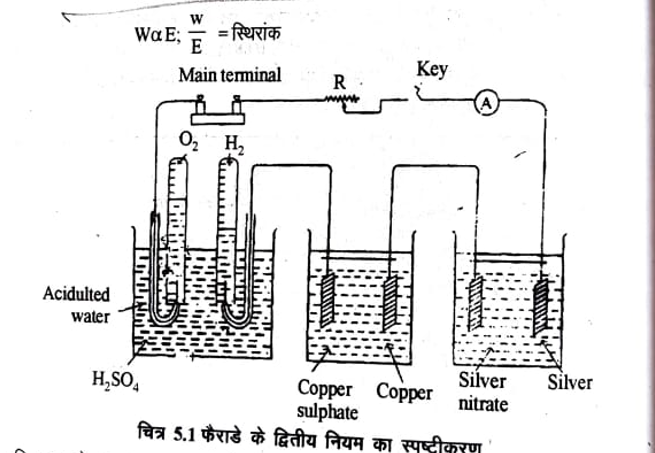
चित्र 5.1 के अनुसार उपकरण आयोजित कर उसमें विद्युत की समान मात्रा (एक कूलॉम) प्रवाहित करें जिनमें क्रमशः तनु H2SO4, CuSO4 और AgNO3 वैद्युत अपघट्य के विलयन भरे हो तो कैथोड़ पर मुक्त हाइड्रोजन, कॉपर तथा सिल्वर के भारों की गणना करने पर पाया कि सदैव अपने तुल्यांकी भारों क्रमशः 1 : 31.78 : 107.88 के अनुपात में होगें।
यदि किन्ही दो सैलों से मुक्त होने वाली पदार्थ की मात्राए w1 व w2 और उनके रासायनिक तुल्याक E1 और E2 होतो
अतः किसी पदार्थ का विद्युत रासायनिक तुल्यांक उसके रासायनिक तुल्यांक के समानुपाती होता है। प्रायोगिक रूप से एक कूलॉम आवेश (एक ऐम्पियर विद्युत धारा को एक सैकण्ड तक प्रवाहित करने पर) को सिल्वर नाइट्रेट के विलयन में से प्रवाहित करने पर 0.0011180 ग्राम सिल्वर निक्षेपित होती है। फैराडे के प्रथम नियम के अनुसार किसी भी आयन की मात्रा जो निक्षेपित (deposit) होती है वह विद्युत धारा की मात्रा की समानुपाती होती है।
अतः विद्युत धारा की वह मात्रा जो एक ग्राम तुल्यांक सिल्वर को निक्षेपित करने में आवश्यक है-
इसी प्रकार एक ग्राम तुल्यांक हाइड्रोजन या एक ग्राम तुल्यांक कॉपर को निक्षेपित करने के लिए भी विद्युत धारा की आवश्यक मात्रा
अतः किसी पदार्थ के एक ग्राम तुल्यांक मुक्त करने के लिए 96495 कूलॉम अथवा 96500 कूलॉम की आवश्यकता होती है। विद्युत की इस मात्रा को अर्थात 96500 कूलॉम को एक फैराडे (F) कहते हैं। यह ध्यान देने योग्य है कि विद्युत की यह मात्रा पदार्थ की प्रकृति पर निर्भर नहीं करती और सदैव स्थिर रहती है।
फैराडे (F)- विद्युत की वह मात्रा है जो किसी पदार्थ के एक ग्राम तुल्यांक भार को घोलने अथवा निक्षेपित करने के लिए प्रयुक्त होती है। F = 96500 कूलॉम- एक फैराडे विद्युत प्रवाहित करने पर पदार्थ का एक ग्राम तुल्यांक मुक्त होता है। 96500 ऐम्पियर विद्युत धारा एक सैकेण्ड तक प्रवाहित की जाती है तो किसी पदार्थ के E ग्राम मुक्त होते हैं । (E तुल्यांक भार है)। इसलिए 1 सैकेण्ड तक 1 ऐम्पियर विद्युत धारा के प्रवाहित होने पर निक्षेपित होने वाले पदार्थ की मात्रा I x1xE /96500 ग्राम है। अतः फैराडे नियमों को गणितीय रूप में निम्न समीकरण द्वारा प्रदर्शित किया जाता है-
उपरोक्त समीकरण से विद्युत धारा का मापन किया जा सकता है इस कार्य के लिए जिस उपकरण का उपयोग करते हैं उसे कूलोमीटर (Coulometer) अथवा वोल्टामीटर (Voltameter) कहते है। चित्र 5.1 में श्रेणी में व्यवस्थित विभिन्न वोल्टामीटर है।
1 फैराडे आवेश वास्तव में एक मोल इलेक्ट्रॉनों पर आवेश के तुल्य होता है ।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics