Ethers and Epoxides in hindi ईथर एवं एपॉक्साइड क्या है नामकरण Nomenclature संरचना एवं बंध
ईथर एवं एपॉक्साइड क्या है नामकरण Nomenclature संरचना एवं बंध Ethers and Epoxides in hindi ?
ईथर एवं एपॉक्साइड (Ethers and Epoxides)
ईथर (Ethers)
प्रस्तावना (Indroduction)
वे कार्बनिक यौगिक जिनमें द्विसंयोजी ऑक्सीजन परमाणु की दोनों संयोजकताएँ एल्किल समूह से सन्तुष्ट हो, ईथर अथवा ऐल्कॉक्सी ऐल्केन कहलाते हैं। इनका सामान्य सूत्र R-O-R’ होता है (R तथा R’ = ऐल्किल समूह)। R तथा R’ के समान होने पर इन्हें साधारण ईथर (simple ethers) और असमान होने पर मिश्र ईथर (mixed ethers) कहते हैं। ईथर में ऐल्किल समूहों स्थान पर ऐरिल समूह भी हो सकते हैं ।
ईथर को ऐल्केनॉल के ऐनहाइड्राइड भी कहा जाता है । ऐल्केनॉल के दो अणुओं से जल के एक अणु के विलोपन पर ईथर प्राप्त होता है। एथेनॉल के निर्जलीकरण पर डाइएथिल ईथर (एथॉक्सी एथेन) बनता है।
यदि ऐल्केनॉल को जल का मोनो ऐल्किल व्युत्पन्न मानें तो ईथर को जल का डाइऐल्किल व्युत्पन्न कहा जाता है।
ईथर ऐल्किल ऑक्साइड के नाम से भी जाने जाते हैं। उदाहरणार्थ –
नामकरण ( Nomenclature)
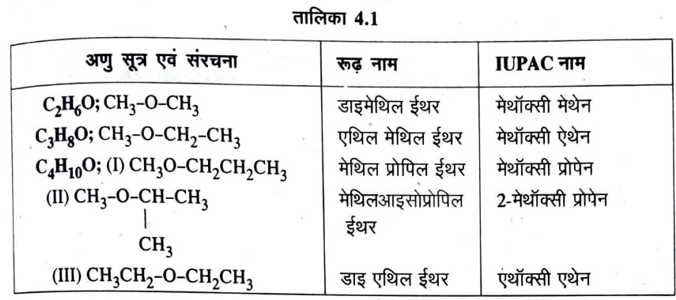
नामकरण की रूढ़ पद्धति में इन्हें ऑक्सीजन परमाणु से बन्धित ऐल्किल समूहों को अंग्रेजी वर्णमाला के क्रम में लिखकर ‘ईथर’ शब्द द्वारा संलग्नित कर देते हैं। IUPAC पद्धति में इन्हें ऐल्केन (R-H) से एक हाइड्रोजन परमाणु (H) को ऐल्कॉक्सी समूह (-OR) द्वारा प्रतिस्थापित यौगिक मानकर ‘ऐल्कॉक्सी ऐल्केन’ नाम दिया जाता है। ईथर के दोनों ऐल्किल समूहों में से कम कार्बन परमाणु युक्त ऐल्किल समूह को ऐल्कॉक्सी समूह का भाग और दूसरे को ऐल्केन का अवशेष मानते हैं। तालिका (4.1) में चार कार्बन परमाणु तक के ईथर के रूढ़ तथा IUPAC पद्धति में नाम तथा उनकी संरचनाएँ दी गई है—
चक्रीय ईथर में ऑक्सीजन परमाणु वलय का भाग होता है। चक्रीय ईथर विषमचक्रीय यौगिक होते हैं। इस चक्रीय ईथर में वलय का साइज बढ़ने पर उनके विशिष्ट नाम निम्न प्रकार दिये गये हैं-
इनमें वलय को संख्या देने के लिए 0 परमाणु को संख्या 1 देते हैं। एथिलीन ऑक्साइड का IUPAC नाम ऑक्सीरेन एवं एथिलीन ऑक्साइड दोनों ही है। ऑक्सेलेन एवं ऑक्सेन के लिये भी क्रमशः टेट्राहाइड्रोफ्यूरेन एवं पेंटाहाइड्रोपाइरेन IUPAC में स्वीकृत नाम है।
यौगिक में दो या अधिक ईथर बंधन (Ether linkage) उपस्थित होने पर उन्हें क्रमशः डाइ, ट्राइ टेट्रा एवं पॉलि ईथर कहते हैं। उदाहरणार्थ
ईथर में संरचना एवं बंधन
ईथर में बंधन की तुलना यदि जल एवं ऐल्कोहॉल से करें तो इसकी संरचना को आसानी से समझा जा सकता है। जल, ऐल्कोहॉल एवं ईथर तीनों में ही ऑक्सीजन परमाणु की संकरित अवस्था sp3 है। जल में H-O-H बंध कोण 104.5° है जबकि मेथेनॉल में C-O-H 108.5° और ईथर में C-O-C बंध कोण ऐल्किल समूहों के वान्डरवाल्स प्रतिकर्षण के कारण और भी अधिक बढ़ जाता है। डाइमेथिल ईथर में C-O-C बंध कोण लगभग 112° है जबकि डाइ – ब्यूटिल ईथर जिसमें ऐल्किल समूह बहुत बड़े आकार के हैं, में 132° है। अतः यह कहा जा सकता है कि ऑक्सीजन परमाणु पर ऐल्किल समूहों का आकार बढ़ने पर C-O-C बंध कोण बढ़ जाता है क्योंकि ऐल्किल समूहों के मध्य वान्डरवाल्स प्रतिकर्षण बढ जाते हैं ।
ईथर में C-O बंध लम्बाई C-C एकल बंध लम्बाई की अपेक्षा छोटी है। डाइमेथिल ईथर में C-O बंध लम्बाई 1.41 Å जबकि मेथेनॉल में 1.42Å जोकि C-C बंध लम्बाई 1.54Å से कम है।
विरचन की सामान्य विधियाँ (Methods of preparation)
(1) ऐल्कोहॉल के अन्तराआण्विक निर्जलीकरण से (i) ऐल्कोहॉल के आधिक्य को अम्ल के साथ कम ताप पर गर्म करने पर ईथर बनते हैं।
ऐल्कोहॉल के निम्न ताप पर निर्जलीकरण से ईथर और उच्च ताप पर निर्जलीकरण से ऐल्कीन बनते हैं।
सीधी श्रृंखला वाले प्राथमिक ऐल्कोहॉल SN2 क्रिया – विधि से और तृतीयक ऐल्कोहॉल SN1 क्रियाविधि से अभिक्रिया करते हैं। द्वितीयक ऐल्कोहॉल SN1 या SN2 दोनों क्रिया – विधि से अभिक्रिया कर सकते हैं। ऐल्कोहॉल नाभिक स्नेही की भाँति कार्य करते हैं ।
SN2 क्रिया-विधि- पद- 1- ऐल्कोहॉल अम्ल से प्रोटॉन ग्रहण करता है। यह एक अम्ल-क्षार अभिक्रिया
पद 2 – ऐल्कोहॉल का दूसरा अणु नाभिक स्नेही की भांति कार्य करता है और प्रोटॉनीकृत ऐल्कोहॉल पर आक्रमण करता है।
SN1 क्रियाविधि पद 1- ऐल्कोहॉल का अम्ल के द्वारा प्रोटॉनीकरण
पद-2 प्रोटॉनीकृत ऐल्कोहॉल से कार्बोनियम आयन का बनना
पद 3 – प्रोटॉनीकृत ईथर प्रोटॉन का जल के अणु पर स्थानान्तरण कर देता है।
पद 4- प्रोटॉनीकृत ईथर द्वारा प्रोटॉन का जल पर स्थानान्तरण
(ii) ऐल्कोहॉल वाष्पों को गर्म उत्प्रेरकों जैसे ऐलुमिना, ऐलुमिनियम फॉस्फेट आदि पर से प्रवाहित करने पर भी ऐल्कोहॉल का निर्जलीकरण होकर ईथर बनते हैं। अभिक्रियाओं में ताप का अवश्य ध्यान रखा जाता है क्योंकि उच्च तापक्रम पर ऐल्कीन बनते हैं।
यदि अभिक्रिया का तापक्रम 380°C कर दें तो ईथर के स्थान पर एथीन प्राप्त होती है।
(2) ऐल्कोहॉल के ऐल्किलीकरण से तृतीयक ब्यूटिल ईथर का संश्लेषण
प्राथमिक ऐल्कोहॉल को सल्फ्यूरिक अम्ल में घोलकर उसमें आइसोब्यूटिलीन मिलाने पर तृतीयक ब्यूटिल ईथर सुगमता से प्राप्त हो जाते हैं।
यदि उपर्युक्त अभिक्रिया में R=H लें तो तृतीयक ब्यूटिल मेथिल ईथर प्राप्त होता है। यह ईथर गैसोलीन की ऑक्टेन संख्या बढ़ाने में प्रयुक्त होता है। इसलिये तृतीयक ब्यूटिल मेथिल ईथर को औद्योगिक रूप से बनाया जाता है।
(3) विलियमसन संश्लेषण (Williamson’s Synthesis) – यह मिश्रित ईथर बनाने की सामान्य अभिक्रिया है। इसमें ऐल्किल हैलाइड की ऐल्किल सल्फोनेट या ऐल्किल सल्फेट की अभिक्रिया सोडियम या पोटैशियम ऐल्कॉक्साइड के साथ करते हैं। इस विधि से सरल एवं मिश्र दोनों प्रकार के ईथर बनाये। जा सकते हैं। यह एक SN2 अभिक्रिया है।
एक मिश्र ईथर बनाने के लिए उपयुक्त अभिकर्मक लेना आवश्यक है। मुख्य रूप से एक प्राथमिक ऐल्किल हैलाइड लेना चाहिये क्योंकि द्वितीयक तथा तृतीयक ऐल्किल हैलाइड प्रबल क्षार की उपस्थि में विलोपन अभिक्रिया देते हैं, मुख्य उत्पाद ऐल्कीन बनते हैं। उदाहरणार्थ-यदि एथिल तृतीयक ब्यूटिल ईथर बनाना हो तो एथिल ब्रोमाइड एवं सोडियम तृतीयक ब्यूटॉक्साइड लेना चाहिये ।
यदि तृतीयक ब्यूटिल ब्रोमाइड और सोडियम एथॉक्साइड लेंगे तो तृतीयक ब्यूटिल ब्रोमाइड प्रबल क्षार सोडियम एथॉक्साइड की उपस्थिति में विलोपन अभिक्रिया द्वारा 2-मेथिल प्रोपीन बनायेगा ।
एथिल हैलाइड की सोडियम एथॉक्साइड के साथ अभिक्रिया से एथॉक्सी एथेन प्राप्त होता है।
(4) ऐल्कोहॉलों पर डाइऐजोमेथेन की अभिक्रिया से ऐल्कोहॉलों पर डाइऐजोमेथेन की अभिक्रिया से मेथिल ईथर बनते हैं ।
(5) निम्नतर ईथर से उच्चतर ईथर का निर्माण : a- मोनोक्लोरो ईथर और ग्रीन्यार अभिकर्मक की परस्पर अभिक्रिया से उच्चतर ईथर प्राप्त होते हैं।
निम्नतर ईथर के हैलोजन व्युत्पन्न ग्रीन्यार अभिकर्मक के साथ क्रिया करवाने पर
भौतिक गुण (Physical Properties)
निम्नतर सदस्य गैस हैं अथवा वाष्पशील द्रव हैं। इनकी वाष्प बहुत अधिक ज्वलनशील (Inflammable) होती है। समान कार्बन-युक्त ऐल्कोहॉल की अपेक्षा इनके क्वथनांक कम होते हैं क्योंकि इनमें हाइड्रोजन बंध द्वारा आण्विक संगुणन सम्भव नहीं है। इनका घनत्व जल की अपेक्षा कम होता है। ये जल से हल्के और उसमें अविलेय है। जल में इनकी विलेयता को ऐल्कोहॉल मिलाकर बढ़ाया जा सकता है। ईथर के कुछ भौतिक गुण सारणी 4.2 में दिये गये हैं।
रासायनिक गुण (Chemical properties)
ईथर की संरचना R – CH2 – O – CH2 – R से स्पष्ट है कि यह निम्नलिखित चार प्रकार की रासायनिक अभिक्रियाएँ देते हैं-
(अ) ऐल्किल समूह की प्रतिस्थापन अभिक्रियाएँ,
(ब) ईथरीय ऑक्सीजन परमाणु पर उपस्थित एकाकी इलेक्ट्रॉन युग्मों के कारण अभिक्रियाएँ,
(स) C-O बन्ध विदलन अभिक्रियाऐं (C-O bond cleavage reaction)
(द) अन्य अभिक्रियायें
ऐल्किल समूहों की प्रतिस्थापन अभिक्रियाएँ ( Substituion reactions of alkyl groups) – (1) हैलोजनीकरण (Halogenation) – क्लोरीन अथवा ब्रोमीन के साथ गर्म करने पर ईथर के a- कार्बन परमाणु पर हैलोजनीकरण हो जाता है। ईथरीय ऑक्सीजन परमाणु से संलग्नित कार्बन पर उपस्थित हाइड्रोजन परमाणु हैलोजन परमाणु (क्लोरीन अथवा ब्रोमीन) के द्वारा प्रतिस्थापित हो जाता है। प्रतिस्थापित उत्पाद अभिक्रिया की दशा पर निर्भर करता है। एथॉक्सी एथेन की हैलोजन के साथ अभिक्रिया का उदाहरण लेते हैं।
(ii) सूर्य के प्रकश में- क्लोरीन से अभिक्रिया पर परक्लोरोडाइएथिल ईथर बनता है।
ईथरी ऑक्सीजन परमाणु पर उपस्थित एकाकी इलेक्ट्रॉन युग्मों के कारण अभिक्रियायें (Reactions due to lone pairs of electrons on etheral oxygen)-
(i) स्वतः ऑक्सीकरण (Auto oxidation) – परॉक्साइड का बनना (Formation of peroxide) – ऐसे ईथर जिनमें a- कार्बन परमाणु पर हाइड्रोजन परमाणु उपस्थित होते हैं, वायु की ऑक्सीजन द्वारा ऑक्सीकृत हो जाते हैं। उदाहरणार्थ, यदि डाइएथिल ईथर को वायु के सम्पर्क में अपेक्षाकृत लम्बे समय तक (सप्ताह से महीनों तक) छोड़ दें तो इसका स्वतः ऑक्सीकरण (auto oxidation) हो जाता है और इसमें 1-एथॉक्सी एथिल हाइड्रोपरॉक्साइड की अशुद्धि उत्पन्न हो जाती है। यह एक विस्फोटक प्रकृति का पदार्थ होता है। इस परॉक्साइड के बनने को रोकने के लिए ईथर में क्यूप्रस ऑक्साइड मिला देते हैं।
यदि ईथर में परॉक्साइड उपस्थित हो तो इसको प्रयोग में लेते समय विस्फोट की संभावना रहती है अतः प्रयोग में लेने से पूर्व इसमें फेरस अमोनियम सल्फेट तथा पोटैशियम थायोसायनेट विलयन मिलाते हैं। लाल रंग की उपस्थिति ईथर में परॉक्साइड की उपस्थिति को दर्शाती है।
ईथर में परॉक्साइड की उपस्थिति को दूर करने के लिये इसमें सान्द्र H2SO4 मिलाकर आसवन करते हैं।
(2) ऑक्सोनियम लवणों का बनना (Formation of oxonium salts) – ईथर सांद्र अकार्बनिक अम्लों को घोलकर उनके साथ ऑक्सोनियम लवण बना लेता है। यह यहाँ ब्रॉन्सटेड – लोरी क्षार कार्य करता है। इसी प्रकार ईथर इलेक्ट्रॉन न्यून यौगिकों के साथ लूईस क्षार की भाँति कार्य करके अपने ऑक्सीजन के इलेक्ट्रॉन युग्म की सहायता से उनके साथ उपसंहसंयोजक बन्ध बना लेता है और बने उत्पाद भी ऑक्सोनियम लवण कहलाते हैं।
(i) जब सान्द्र सल्फ्यूरिक अम्ल के साथ गर्म किया जाता है तो यह ऐल्किल हाइड्रोजन सल्फेट बनाता है। अभिक्रिया में पहले ऑक्सेनियम लवण बनता है।
(ii) ये HCl गैस को अपने में घोलकर डाइऐल्किल ऑक्सोनियम क्लोराइड बना लेते है।
(iii) ईथर बोरॉनट्रॉइफ्लुओराइड के साथ अभिक्रिया करके बोरॉनट्राइफ्लुओराइड ईथरेट बनाता है।
C-O बंध के विदलन के कारण अभिक्रियायें (Reactions due to cleavage of C-O bond) (1) जल अपघटन (Hydrolysis) – जब ईथर को तनु H2SO4 के साथ उच्च दाब पर गर्म करते हैं तो एथेनॉल प्राप्त होता है। यदि ईथर को उच्च दाब पर अतितप्त भाप के साथ अभिकृत किया जावे तो भी इसका जल अपघटन होकर एथेनॉल प्राप्त होता है।
(2) हाइड्रोजन हैलाइड के साथ – जब ईथर को प्रबल अम्ल हाइड्रोजन आयोडाइड या हाइड्रोजन ब्रोमाइड के साथ अभिकृत करते हैं तो ऐल्किल हैलाइड एवं ऐल्कोहॉल बनते हैं ।
HBr या HI की अधिकता के साथ 373K पर क्रमशः एथिल ब्रोमाइड अथवा एथिल आयोडाइड और जल प्राप्त होते हैं
मेथिलं ईथर को HI के साथ 373K पर गर्म करने पर मेथिल आयोडाइड बनता है इस अभिक्रिया का उपयोग मेथॉक्सी समूह के मात्रात्मक आकलन (Quantitative estimation) में किया जाता है। इसे जीसल विधि (Ziesel’s method) कहते हैं। अभिक्रिया SN1 या SN2 दोनों प्रकार से हो सकती हैं। यह ईथर में उपस्थित ऐल्किल समूहों पर निर्भर करता है।
क्रियाविधि – HX के साथ अभिक्रिया की क्रियाविधि निम्न प्रकार है-
(अ) S2 क्रियाविधि अम्ल (HX ) के द्वारा ईथर का प्रोटॉनीकरण होता है। प्रोटॉनीकृत ईथर पर हैलाइड आयन (X) नाभिक स्नेही का आक्रमण होता है। अभिक्रिया को निम्नलिखित पदों में प्रदर्शित
यदि HX अधिकता में उपस्थित हो तो उत्पाद के रूप में प्राप्त ROH, HX से अभिक्रिया कर लेता
(ब) SN1 क्रियाविधि – इसमें प्रोटॉनीकृत ईथर से कार्बोनियम आयन बनता है—
नोट- यदि मिश्र ईथर में एक मेथिल समूह है और दूसरा प्राथमिक या द्वितीयक ऐल्किल समूह है। तो मेथिल हैलाइड बनता है और अभिक्रिया SN 2 क्रियाविधि से सम्पन्न होती है। उदाहरणार्थ –
यदि एक समूह मेथिल और दूसरा तृतीयक ऐल्किल हो तो मेथिल ऐल्कोहॉल बनता है और अभिक्रिया SNI क्रियाविधि से होती है। उदाहरणार्थ –
विभिन्न हाइड्रोजन हैलाइडों की क्रियाशीलता का क्रम निम्न प्रकार है-
HI’ > HBr > HCl
साइक्लिक ईथर से डाइहैलाइड का एक अणु प्राप्त होता है।
ऐल्किल ऐरिल ईथर की HI के साथ अभिक्रिया पर फीनोल एवं ऐल्किल आयोडाइड बनते हैं।
(3) अपचयन – डाइएथिल ईथर का सोडियम तथा द्रव अमोनिया में अपचयन पर ऐल्केन तथा ऐल्केनॉल प्राप्त होते हैं ।
(4) ऐसीटिल क्लोराइड के साथ – निर्जल AICI3 अथवा ZnCl2 अथवा MgCl2 की उपस्थिति में ईथर ऐसीटिल क्लोराइड से अभिक्रिया करके एथिल ऐसीटेट तथा एथिल क्लोराइड बनाता है।
(5) ऐसीटिक ऐनहाइड्राइड के साथ – शुष्क ZnCl2 की उपस्थिति में यह ऐसीटिक ऐनहाइड्राइड के साथ गर्म करने पर एथिलऐसीटेट देता है।
(द) अन्य अभिक्रियाएँ (Other reactions) – (1) कार्बनमोनोक्साइड के साथ – ईथर कार्बनमोनोक्साइड के साथ 398-423K तापक्रम एवं 500 वायुमण्डल दाब पर उत्प्रेरक BF एवं जल (थोड़ी मात्रा में) की उपस्थिति में एथिल प्रोपेनोएट (एस्टर) बनाता है।
(2) दहन (Combustion) – डाइएथिल ईथर एक अत्यन्त ज्वलनशील द्रव है। यह वायु में प्रकाशंयुक्त ज्वाला के साथ जलकर कार्बनडाइऑक्साइड तथा जल बनता है।
(3) निर्जलीकरण (Dehydration) – डाइएथिल ईथर वाष्प को उत्प्रेरक ऐलुमिना पर प्रवाहित करने पर इसमें से जल का अणु निकल जाता है तथा ऐल्कीन प्राप्त होती है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics