Equilibrium Constant in hindi formula derivation साम्यवस्था स्थिरांक किसे कहते हैं सूत्र लिखिए
साम्यवस्था स्थिरांक किसे कहते हैं सूत्र लिखिए Equilibrium Constant in hindi formula derivation ?
साम्यवस्था स्थिरांक (Equilibrium Constant)
द्रव्य अनुपाती क्रिया नियम तथा साम्य की अवस्था द्वारा अभिक्रियाओं के साम्यवस्था स्थिरांक का अध्ययन किया जाता है जो कि अभिक्रियाओं के वेग से सम्बन्धित महत्वपूर्ण एव उपयोगी सूचना देता है। माना कि
यह एक समांग एवं सामान्य उत्क्रमणीय अभिक्रिया है ।
द्रव्य अनुपाती क्रिया नियम के अनुसार
………(1)
Kfअग्र अभिक्रिया (Forward Reaction) का वेग स्थिरांक हैं।
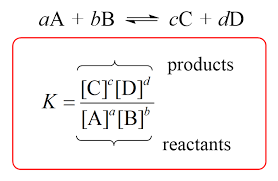
Kf तथा Kf वेग स्थिरांक हैं। इस दोनों का अनुपात भी स्थिरांक होगा। यह स्थिरांक साम्यवस्था स्थिरांक (Equilibrium constant) कहलाता है। इसे Kc द्वारा प्रदर्शित करते हैं-
यहाँ यह ध्यान रखना आवश्यक है कि [A], [B], [C] तथा [D] क्रमश: A,B,C,D की साम्यवस्था पर सान्द्रतायें हैं। अतः साम्यवस्था स्थिरांक को निम्न प्रकार परिभाषित किया जा सकता है-
एक संतुलित अभिक्रिया में उत्पादों की साम्यवस्था सान्द्रता के गुणनफल तथा अभिकारकों की साम्यवस्था सान्द्रता के गुणनफल का अनुपात जबकि प्रत्येक सान्द्रता पद की घात उस समीकरण में उपस्थित पदार्थ के गुणांक के बराबर हो, उस अभिक्रिया का साम्यवस्था स्थिरांक कहलाता है ।
उदाहरण के लिये अभिक्रिया N2 + 3H2 = 2NH3 का साम्यवस्था स्थिरांक (Kc) निम्न प्रकार लिखा जाता है।
आंशिक दाबों के रूप में साम्यवस्था स्थिरांक (Equilibrium Constant in terms of Partial pressure):- यदि अभिक्रिया में अभिकारक और उत्पाद गैसीय अवस्था में हो तो उनकी सान्द्रताओं को उनके आंशिक दाबों के रूप में व्यक्त किया जा सकता है।
आदर्श गैस समीकरण के अनुसार
अर्थात् निश्चित ताप पर किसी गैसीय पदार्थ का आंशिक दाब उसकी मोलर सान्द्रता (C) के समानुपाती होता है।
वेग, वेग स्थिरांक और साम्य स्थिरांक की इकाईयाँ (Units of Rate, Rate Constant and Equilibrium constant) वेग (Rate/Velocity):- इकाई समय में हुई सान्द्रता परिवर्तन अभिक्रिया का औसत वेग कहलाता है।
C = सान्द्रता परिवर्तन t = परिवर्तन में लगा समय
(+) चिन्ह उत्पादों की सान्द्रता परिवर्तन तथा (-) चिन्ह अभिकारकों की सान्द्रता परिवर्तन दर्शाता है क्योंकि समय बढ़ने पर उत्पादों की सान्द्रता बढ़ती है, जबकि अभिकारकों की सान्द्रता घटती है
अतः अभिक्रिया वेग की इकाई मोल लीटर- 1 समय -1 है ।
अभिक्रिया के वेग के अनुसार समय सैकण्ड, मिनट अथवा घण्टों में हो सकता है।
वेग स्थिरांक (Rate constant ) :- एक सामान्य अभिक्रिया
प्रायोगिक आंकड़ों से साम्यस्थिरांक की गणना (Calculation of Equilibrium constant from Experimental Information)
प्रायोगिक आंकड़ों के आधार पर अभिक्रिया के साम्य स्थिरांक Kc अथवा Kp की गणना की जाती है। इन गणनाओं में प्रमुख पद निम्नलिखित हैं ।
(i) दी हुई अभिक्रिया के लिये Kc अथवा Kp के व्यंजक को लिखिये
(ii) अभिकारकों की निश्चित सान्द्रता लेकर अभिक्रिया कराई जाती है। साम्यवस्था पर किसी एक अभिकारक अथवा उत्पाद की सान्द्रता प्रायोगिक रूप से ज्ञात की जाती है इसके पश्चात सभी अभिकारकों और उत्पादों की साम्यवस्था सान्द्रता रससमीकरण मिति (Stoichiometry) द्वारा ज्ञात की जाती है। मांना की A के a मोल तथा B के b मोल प्रारम्भ में लिये जाते हैं और साम्यवस्था पर A के x मोल क्रिया कर लेते हैं । समीकरण के आधार पर साम्यवस्था पर B के 3/2 x मोल क्रिया करेंगे जबकि C के x मोल तथा D के x/2 मोल बनेगे। यदि अभिक्रिया पात्र का आयतन V लीटर हो तो A, B, C तथा D की
साम्यवस्था पर सान्द्रतायें निम्न प्रकार होंगी-
(ii) द्वितीय पद में प्राप्त साम्यवस्था सान्द्रताओं को Kc के व्यंजक में प्रतिस्थापित करके गणना करते हैं।
अभिकारक अथवा उत्पाद की साम्यवस्था सान्द्रता ज्ञात करने के लिये उनके भौतिक गुण जैसे चालकता (Conductivity), रंग की तीव्रता (Intensity of colour), pH प्रकाशिक घूर्णन आदि का उपयोग करते हैं। क्योंकि सान्द्रता में परिवर्तन के साथ इन गुणों में भी परिवर्तन होता है ।
गैसीय अभिक्रिया के आयतन परिवर्तन वाष्पघनत्व (Vapour density) आदि का उपयोग साम्यवस्था सान्द्रता ज्ञात करने में किया जाता है।
विभिन्न प्रकार की अभिक्रिया के Kc अथवा Kp के मान ज्ञात करने की विधियाँ निम्न प्रकार है।
गसीय अभिक्रियायें (Gaseous Reactions)
3.7.1वे अभिक्रियायें जिनमें n = 0 :- वे अभिक्रियायें जिनमें उत्पादों के मोल और अभिकारकों के मोल समान होते हैं उनमें n = 0
(i) हाइड्रोजन आयोडाइड का संश्लेषण (Synthesis of Hydrogen lodide):-
प्रारम्भ में H2 और L2 के क्रमशः a मोल और b मोल बंद पात्र जिसका आयतन V है में लिये जाते हैं। इस पात्र को लगभग 400 K पर साम्य स्थापित होने तक गर्म करते हैं।
साम्यवस्था पर माना कि हाइड्रोजन और आयोडीन के x मोल क्रिया करते हैं और 2x मोल HI बनता हैं। साम्यवस्था पर H2 , I2 तथा HI की सान्द्रतायें निम्न प्रकार से व्यक्त करते हैं।
3.7.2 अभिक्रिया जिनमें n< 0 :- वे अभिक्रियायें जिनमें उत्पादों के मोलों की संख्या अभिकारकों के मोलों की संख्या से कम होती है उनमें n < 0 होता है ।
उदाहरण के लिये
(i) N2 और H2 द्वारा NH3 का निर्माण (Manufacture of NH3 from N2 and H2 )
N2(g) + 3H2(g) = 2NH3(g)
साम्यवस्था पर नाइट्रोजन के x मोल क्रिया कर लेते हैं। यदि पात्र का आयतन V हो तो
……………………(17)
(ii) SO2 का ऑक्सीकरण:- H2SO4 के निर्माण में SO2 गैस का SO3 में ऑक्सीकरण निम्न समीकरण द्वारा सम्पन्न होता है।
इस अभिक्रिया के Kc और Kp के मान भी निम्न प्रकार से ज्ञात किये जा सकते हैं।
Kc की गणना
माना कि साम्यवस्था पर O2 के मोल क्रिया कर लेते हैं
3.7.3 अभिक्रियाएं जिनमें n > 0 :- वे अभिक्रियायें जिनमें गैसीय उत्पादों के मोलों की संख्या गैसीय अभिकारकों के मोलों की संख्या से अधिक हो में n > 0 होता है। उदाहरण के लिए
अधिकांश वियोजन अभिक्रियाओं में n का मान धनात्मक (+ve) होता है। इन अभिक्रियाओं के लिए वियोजन की सीमा अर्थात् वियोजन की मात्रा (Degree of Dissociation) के रूप में Kc और Kp के मान ज्ञात करना सरल होता है
वियोजन की मात्रा को सामान्यतया a से व्यक्त किया जाता है ।
उदाहरण के लिए
PCI5(g) =→ PCI3 (8) + CI2 (8)
माना कि प्रारम्भ में PCI5 के x मोल लिये जाते हैं।
साम्यवस्था पर माना कि PCI के x मोल वियोजित हो जाते हैं तो-
वियोजन की मात्र (a) = x/a
अर्थात् 1 मोल PCI5 में से वियोजित हुये मोल की मात्रा उसकी वियोजन की मात्रा कहलाती है।
अतः किसी अभिकारक के 1 मोल में से वियोजित हुये मोल की मात्रा उसकी वियोजन की मात्रा होगी।
(i) PCI5 वियोजन का Kc ज्ञात करना:- PCI5 का वियोजन निम्न प्रकार होता है
PCI5(g) === PCI3 (8) + Cl2 (g)
माना कि प्रारम्भ में PCI5 के a मोल V लीटर के एक पात्र में लिये जाते हैं साम्यवस्था PCI5 के वियोजन की मात्रा यदि a हो तो –