congruent melting point phase diagram in hindi सर्वांगसम गलनांक किसे कहते हैं
सर्वांगसम गलनांक किसे कहते हैं congruent melting point phase diagram in hindi ?
हिमकारी मिश्रण (Freezing Mixtures)
बर्फ में साधारण नमक मिलाने पर उसके ताप में अत्यधिक कमी आती है। लगभग 23% साधारण नमक मिलाने पर उसका ताप – 22°C तक पहुँच जाता है। साधारण नमक के अतिरिक्त अन्य लवण जैसे NH4CI, KNO3, KI आदि को बर्फ में मिलाने पर बर्फ का ताप काफी कम हो जाता है। इस प्रकार के मिश्रण हिमकारी मिश्रण (Freezing mixture) कहलाते हैं। इसे NaCl-H2 O आरेख चित्र 4.10 से समझाया जा सकता है।
माना कि लवण NaCl को 0°C पर बर्फ में मिलाया जाता है। जिसमें थोड़ा सा जल भी उपस्थित है। (बिन्दु A) अतः हम वक्र AB के सहारे चलते हैं। चूंकि कुछ लवण जल में घुल जाएगा अतः यहाँ तीन प्रावस्थाएं लवण बर्फ व विलयन प्राप्त होगी। लेकिन ये तीनों प्रावस्थाऐं स्थायी साम्यवस्था में केवल गलन क्रान्तिक ताप (Eutectic temperature) पर ही एक साथ रह सकती है। अधिकांशतः यह ताप बर्फ के सामान्य हिमांक ( गलनांक) से कम होता है। अतः बर्फ और पिघल जाऐगी जिससे संघटन का परिवर्तन वक्र AB के अनुसार परिवर्तित होगा। बर्फ के पिघलने व लवण के घुलने दोनों ही प्रक्रमों में ऊष्मा का अवशोषण होगा। यदि तंत्र पारिपार्श्विक से ऊष्मा न लेने की स्थिति में हो तो तंत्र का ताप कम हो जाएगा। अर्थात् मिलाए लवण का अनुपात जितना अधिक होगा उतना ही अवनमन अधिक होगा यह ताप की कमी वक्र AB द्वारा दर्शायी जाती है। तथा यह ताप में कमी तब तक होती रहेगी जब तक कि ताप गलन क्रान्तिक ताप B तक नहीं पहुंच जाए अथवा जब तक लवण या बर्फ पूर्ण रूप से घुल नहीं जाए। अतः लवण के आधिक्य तथा बर्फ कि उपस्थिति में प्राप्त होने वाला न्यूनतम ताप तंत्र के गलन क्रान्तिक ताप पर निर्भर करता है। इस प्रकार किसी हिमकारी मिश्रण द्वारा उत्पन्न न्यूनतम ताप हिम क्रान्तिक ता (Cryohydric temperature) होगा व संघटन हिम क्रान्तिक संघटन (Cryohydric composition) कहलाता है। दूसरी ओर यदि हम लवण का संतृप्त विलयन ले और उसमें बर्फ मिलाए तो हम CB के सहारे चलते हैं। तब तक कि बिन्दु B नहीं पहुंच जाए। इस प्रकार वही न्यूनतम ताप प्राप्त होगा चाहे हम बर्फ में नमक मिलाए या नमक में बर्फ मिलाए।
(A) एसीटोन-शुष्क बर्फ हिमकारी मिश्रण (Acetone-Dry ice Freezing Mixture)
एसीटोन – शुष्क बर्फ (ठोस कार्बन डाईऑक्साइड) मिश्रण भी एक हिमकारी मिश्रण है। इस मिश्रण द्वारा शीतलन इस सिद्धान्त पर आधारित है कि शुष्क बर्फ अर्थात् ठोस कार्बनडाइ ऑक्साइड वायुमण्डलीय दाब पर सीधे गैसीय अवस्था में परिवर्तित होती है। जब ऐसीटोन में शुष्क बर्फ मिलाई जाती है तो शुष्क बर्फ एसीटोन से ऊष्मा लेकर उर्ध्वपातित (sublime) होती है और वाष्प कार्बनडाई ऑक्साइड बनाती है। परिणामस्वरूप तंत्र का ताप गिरने लगता है अर्थात् शीतलन (coiling) होने लगता है।
यदि एसीटोन में शुष्क बर्फ पर्याप्त मात्रा में (sufficient amount ) मिलाया जाए तो एसीटोन का ताप – 95°C तक (जो कि एसीटोन का हिमांक बिन्दु है) पहुँच जाता है। यह ताप तब तक ही रहता है जब तक कि पर्याप्त मात्रा में शुष्क बर्फ एसीटोन में उपस्थित रहे।
परन्तु वास्तव में विकीरण के कारण यह ताप लगभग 60°C के आस-पास रहता है जो कि काफी निम्न ताप है। इसी कारण एसीटोन और शुष्क बर्फ (ठोस CO2) के मिश्रण को भी हिमकारी मिश्रण (Freezing Mixture) के रूप में प्रयोग लिया जाता है।
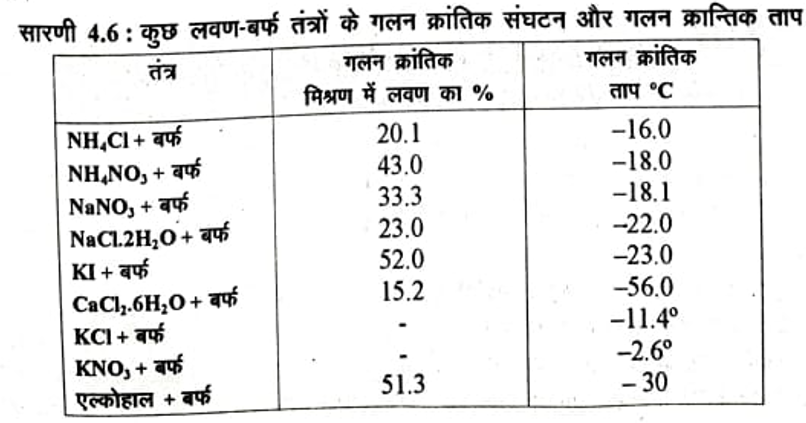
सारणी 4.6 में कुछ लवण- बर्फ तन्त्रों के गलन क्रान्तिक ताप तथा गलन क्रान्तिक संघटन दिये जा रहे हैं।
ठोस विलयन (Solid Solutions)
ऐसे तंत्र जिनमें एक स्थायी यौगिक बनते हैं (Systems in which Two Components forms a stable Compound)
कई ऐसे तंत्र जिनमें धातुए, कार्बनिक यौगिक तथा अकार्बनिक लवण जल में घोलने पर ये तंत्र के दो घटक एक स्थिति में एक दूसरे से रासायनिक संयोग कर एक नया स्थायी यौगिक बनाते हैं। इसी प्रकार दो धातुऐं आपस में मिलती है तो कई माध्यमिक यौगिक या अन्तः धात्विक यौगिक बनाते हैं तथा कई द्वि यौगिक भी बनाते है अगर मिलाने वाले दो यौगिक कार्बनिक हो व लवण व जल दो घटक मिलते हैं तो कई लवण हाइड्रेटस बनाते हैं।
इस प्रकार के तंत्र दो प्रकार के होते हैं-
(i) सर्वागंसम गलनांक रखने वाले यौगिकों का बनना
(Formation of compounds with congruent melting point)
(ii) असर्वागंसम गलनांक रखने वाले यौगिकों का बनना
(Formation of compounds with Incongruent melting point)
सर्वागंसम गलनांक रखने वाले यौगिकों का बनना (Formation of compounds with congruent melting point)
ऐसे तंत्र जिनमें दो घटक आपस में रासायनिक संयोग द्वारा नया स्थायी यौगिक बनाते हैं जो बिना वियोजित हुए निश्चित ताप पर तुरन्त (sharply) पिघल जाते हैं यह पिघलना सर्वागसम (congruent) कहलाता है इस स्थिति में ठोस प्रावस्था व द्रव प्रावस्था दोनों में यौगिक का एक सा संघटन (same com – position in solid and liquid phase) होता है। ऐसे यौगिक को सर्वागसम गलन यौगिक (Congruent melting com – pound) कहते हैं तथा जिस निश्चित ताप पर यह पिघलता है उसे सर्वागंसम गलन ताप (Congruent melting point) या सर्वागसम गलनांक कहते हैं।
अतः ऐसे यौगिक जो एक निश्चित ताप पर द्रव प्रावस्था में पिघल जाते हैं व द्रव प्रावस्था में वही संघटन रखते हैं जो ठोस प्रावस्था में है को सर्वागसम गलन ताप रखने वाले यौगिक कहते हैं।
इसको समझने के लिए A व B दो घटक है जो रासायनिक संयोग कर AB स्थायी ठोस यौगिक बनाते हैं। इनका प्रावस्था आरेख चित्र 4.7 के अनुसार होगा।
इनमें तीन अलग–अलग ठोस प्रावस्था होगी A, B व यौगिक AB, इसके अनुसार तीन गलन बिन्दु वक्र AC, BE, CDE होगें। वक्र AC पर ठोस A व द्रव प्रावस्था साम्य में होंगे। अतः ये एक चर होगे। बिन्दु A शुद्ध ठोस A व बिन्दु B शुद्ध ठोस B का गलन बिन्दु है। वक्र का उच्चतम बिन्दु D यौगिक AB का सर्वागसम बिन्दु है क्योंकि इस बिन्दु पर ठोस तथा द्रव प्रावस्था एक सा संघटन रखते हैं अतः इस तापक्रम पर द्विघटक तंत्र एक घटक तंत्र में परिवर्तित हो जाता है क्योंकि दोनों ठोस व द्रव प्रावस्था मही यौगिक AB रखते हैं। अतः प्रावस्था के अनुसार D एक अचर (nonvariant) बिन्दु है अर्थात निश्चित तापक्रम प्रदर्शित करता है। इस आरेख में यह तापक्रम A व B ठोस के गलन ताप से अधिक है लेकिन AB का सर्वागसम ताप ठोस A व ठोस B के गलन ताप से अधिक कम या इनके मध्य भी हो सकता है। चित्र 4.7 में दो गलन क्रान्तिक बिन्दु C व E है जहाँ बिन्दु C पर ठोस A व ठोस AB तथा बिन्दु E पर ठोस B व ठोस AB द्रव प्रावस्था के साथ साम्य में रहते हैं।
यह देखा गया कि किसी तापक्रम पर द्रव प्रावस्था दो संघटन X व X’ ठोस AB के साम्य में है। अर्थात् यौगिक AB एक ही तापक्रम पर दो विलेयता प्रदर्शित करता है। प्रावस्था आरेख से इसे इस प्रकार समझा सकते हैं कि DD’ एक रेखा है जो वक्र को दो बराबर भागों में बांटती है। बांया भाग A तथा AB का दो घटक तंत्र है। वक्र DC ठोस AB में A मिलाने का गलन वक्र है जबकि DE ठोस AB में B मिला का गलन वक्र है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics