अणु संख्यक गुण क्या है , अणुसंख्य गुणधर्म , अणु संख्या गुणधर्म (colligative properties in hindi)
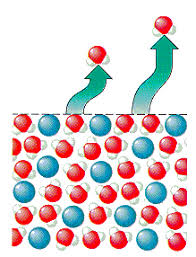
(colligative properties in hindi) अणु संख्यक गुण क्या है , अणुसंख्य गुणधर्म , अणु संख्या गुणधर्म : किसी विलयन का वह गुण जो उसमें उपस्थित विलेय पदार्थ के कणों या अणुओं या आयनों की संख्या पर या मात्रा पर निर्भर करता है , ऐसे गुणों को अणु संख्यक गुण कहते है अर्थात ये वे गुण होते है जो विलयन के विलेय पदार्थ के अणुओं की सांद्रता पर निर्भर करते है।
विलयनों के निम्न गुण है जो विलेय के अणुओं की संख्या पर निर्भर करते है इसलिए इन्हें अणु संख्यक गुण कहते है , ये निम्न है –
1. वाष्प दाब में आपेक्षिक अवनमन
2. क्वथनांक में उन्नयन
3. हिमांक में अवनमन
4. परासरण दाब
अब हम इन अणुसंख्य गुणधर्म के बारे में विस्तार से अध्ययन करते है।
विलयनों के निम्न गुण है जो विलेय के अणुओं की संख्या पर निर्भर करते है इसलिए इन्हें अणु संख्यक गुण कहते है , ये निम्न है –
1. वाष्प दाब में आपेक्षिक अवनमन
2. क्वथनांक में उन्नयन
3. हिमांक में अवनमन
4. परासरण दाब
अब हम इन अणुसंख्य गुणधर्म के बारे में विस्तार से अध्ययन करते है।
1. वाष्पदाब में आपेक्षिक अवनमन
जब किसी शुद्ध विलायक में कोई अवाष्पशील पदार्थ घोल दिया जाता है तो इसके वाष्पदाब में कमी आ जाती है अर्थात शुद्ध अवस्था में विलायक का वाष्प दाब अधिक होता है जब इसमें कोई अवाष्पशील पदार्थ मिला दिया जाता है तो इसके वाष्पदाब में कमी आ जाती है। किसी विलयन में वाष्पदाब में आई इस कमी या अवनमन का मान विलेय पदार्थ के कणों की संख्या या सांद्रता पर निर्भर करता है , इसे ही वाष्पदाब में आपेक्षिक अवनमन कहते है।
2. क्वथनांक में उन्नयन
वह ताप जिस पर किसी द्रव का वाष्प दाब , वायुमंडलीय दाब के बराबर हो जाता है , उस ताप को द्रव का क्वथनांक कहते है।
किसी भी शुद्ध विलयन या द्रव के लिए क्वथनांक का मान नियत रहता है अर्थात एक निश्चित ताप पर प्रत्येक द्रव के लिए द्रव का वाष्पदाब का मान वायुमंडलीय दाब के बराबर हो जाता है।
लेकिन जब किसी शुद्ध द्रव में अवाष्पशील पदार्थ मिलाया जाता है तो इसके वाष्पदाब में कमी या अवनमन हो जाता है अत: द्रव के वाष्पदाब को वायुमंलीय दाब के बराबर करने के लिए इसको अतिरिक्त ताप देना पड़ता है , अर्थात पहले से अधिक ताप पर अब द्रव का वाष्पदाब वयुमंलीय दाब के बराबर होता है अर्थात क्वथनांक का मान अशुद्ध द्रव के बढ़ जाता है या इसके क्वथनांक में उन्नयन हो जाता है , इसे ही क्वथनांक में उन्नयन कहते है।
उदाहरण : किसी शुद्ध जल के लिए क्वथनांक का मान 100 डिग्री सेल्सियस होता है लेकिन जब इस द्रव में ग्लूकोज को घोल दिया जाता है तो अब इस स्थिति में अब विलयन का क्वथनांक का मान 100 डिग्री सेल्सियस से अधिक प्राप्त होता है।
3. हिमांक में अवनमन
वह ताप जिस पर किसी द्रव की द्रव और ठोस अवस्था साम्यावस्था में आ जाती है उस ताप को हिमांक कहते है अर्थात हिमांक बिंदु पर कोई द्रव जमना शुरू हो जाता है।
हम हिमांक को इस प्रकार भी परिभाषित कर सकते है –
“वह ताप जिस पर किसी द्रव का , द्रव तथा ठोस दोनों अवस्थाओं का वाष्प दाब समान हो जाता है , उस ताप को हिमांक कहते है। “
जब किसी शुद्ध द्रव में कोई अवाष्पशील पदार्थ मिला दिया जाता है तो उस पदार्थ का वाष्पदाब कम हो जाता है अर्थात अवाष्पशील या विद्युत अनअपघट्य पदार्थ मिलाने पर वह द्रव अब कम ताप पर जमना शुरू हो जाता है अर्थात द्रव के हिमांक में कमी या अवनमन हो जाता है , इसे ही द्रव का विलयन का हिमांक में अवनमन कहते है।
अर्थात कोई भी द्रव शुद्ध अवस्था में अधिक ताप पर जमता है लेकिन जब इसमें कोई अवाष्पशील या अनअपघट्य घोल दिया जाता है तो यह कम ताप पर जमने लगता है अर्थात इसके हिमांक में अवनमन हो जाता है।
4. परासरण दाब
वह प्रक्रिया जिसमें कोई विलायक अर्द्धपारगम्य झिल्ली से एक विलयन से दुसरे विलयन में गति करता है या शुद्ध विलायक से विलयन की तरफ गति करता है , इस प्रक्रिया को परासरण कहते है।
यहाँ ध्यान से अर्द्धपारगम्य झिल्ली वह परत है जो कुछ कणों को इसके पार जाने देती है लेकिन बाकी कणों को इससे पार नहीं जाने देती है अर्थात अर्द्धपारगम्य झिल्ली से विलायक के कण को एक दूसरी तरफ चले जाते है लेकिन विलेय के कण इससे पार नहीं जा पाते है।
परासरण प्रक्रिया में विलायक का प्रवाह अर्द्धपारगम्य झिल्ली द्वारा कम सांद्रता से अधिक सांद्रता वाले विलयन की तरफ होता है , जब तक दोनों विलयन साम्यावस्था में न आ जाए। यदि हमें इस प्रवाह को रोकना है तो इसके प्रवाह के विपरीत दिशा में दाब लगाना पड़ता है जिससे यह प्रवाह अर्थात विलायक का प्रवाह रुक सके।
यह दाब जो परासरण को रोकने के लिए आरोपित किया जा रहा है इसे ही परासरण दाब कहते है।