chromophore and auxochrome in hindi definition difference वर्णमूलक या क्रोमोफोर वर्णवर्धक क्या है
वर्णमूलक या क्रोमोफोर वर्णवर्धक क्या है chromophore and auxochrome in hindi definition difference ?
पराबैंगनी स्पेक्ट्रम का प्रदर्शन एवं विश्लेषण
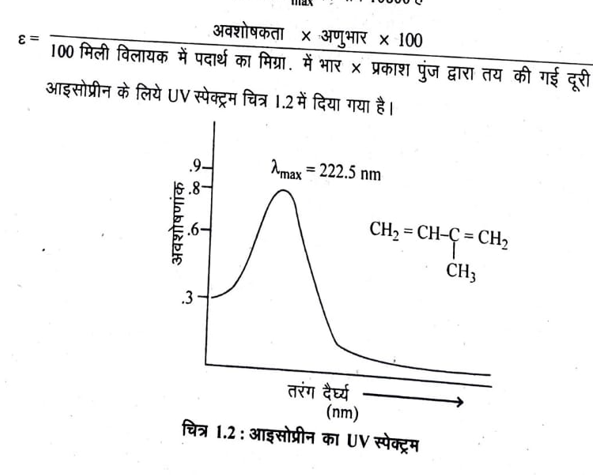
किसी यौगिक (अणुभार लगभग 100-200 ) का पराबैंगनी स्पेक्ट्रम प्राप्त करने के लिये उसके एक मिग्रा. को उपयुक्त विलायक के 100 मिली. में घोलकर एक ‘तनु विलयन बना लेते हैं। इस तनु विलयन का एक भाग स्पेक्ट्रोफोटोमीटर की एक सैल में लेते हैं। दूसरी सैल में संदर्भ विलायक भी लेते हैं। पराबैंगनी प्रकाश के दो समान तरंगदैर्घ्य के पुंजों (Beam of UV light with same wave length) में से एक को विलायक में से तथा दूसरे को संदर्भ विलायक में से गुजारते हैं। पारगमित पुंजों की तीव्रताओं की तुलना से यह पता लगाते हैं कि यौगिक ने किस तरंगदैर्ध्य के विकिरणों का अवशोषण किया है तरंगदैर्घ्य का वह मान जहाँ पर अधिकतम अवशोषण होता है, कहलाता है। प्रयुक्त तरंगदैर्घ्य एवं अवशोषणांक के मध्य प्राप्त ग्राफ को यौगिक का पराबैंगनी स्पेक्ट्रम कहते हैं।
उदाहरणार्थ- आइसोप्रीन के पराबैंगनी स्पेक्ट्रम में 210-240 nm पर एक चौड़ा बैंड (Broad band) प्राप्त होता है तथा 222.5 nm तरंगदैर्घ्य पर अधिकतम तीव्रता का बैंड प्राप्त होता है अर्थात यहाँ अधिकतम अवशोषण होता है। अतः इस यौगिक का का मान 222.5 nm है।
आइसोप्रीन के लिये मोलर अवशोषकता ६ max का मान 10800 है
पराबैंगनी स्पेक्ट्रम (Ultraviolet Spectrum)
जब प्रकाश के दृश्य एवं पराबैंगनी क्षेत्र से ऊर्जा का अवशोषण कर पदार्थ स्पेक्ट्रम प्रदान करते हैं तो 200 से 800 नेनोमीटर तरंगदैर्घ्य के क्षेत्र में अधिकतम अवशोषण बैण्ड (Amax) प्राप्त होते हैं। इस प्रकार के स्पेक्ट्रम में अणु में इलेक्ट्रॉनों का एक इलेक्ट्रॉनीय ऊर्जा स्तर से दूसरे इलेक्ट्रॉनीय ऊर्जा स्तर में संक्रमण होता है। चूंकि ये स्पेक्ट्रम विद्युत चुम्बकीय स्पेक्ट्रम के दृश्य तथा पराबैंगनी क्षेत्रों में बनते हैं अतः इनके अध्ययन को पराबैंगनी एवं दृश्य स्पेक्ट्रोस्कोपी कहते हैं।
इलेक्ट्रॉनीय संक्रमण (Electronic Transitions)
तरंग यांत्रिकी के अनुसार दो परमाण्वीय कक्षक अतिव्यापन कर दो आण्विक कक्षक बनाते हैं- एक बन्धी अणुक कक्षक (bonding molecular orbital) जो कि कम ऊर्जा वाला होता है तथा दूसरा विपरीत बन्धी अणुक कक्षक (Antibonding molecular orbital) जो कि परमाण्वीय कक्षक से अधिक ऊर्जा वाला होता है। जब कोई अणु बनता है तो बन्ध में भाग लेने वाले इलेक्ट्रॉन बन्धक कक्षकों में जाते हैं। कार्बनिक पदार्थों में दो प्रकार के बंध पाए जाते हैं- ० एवं । वे इलेक्ट्रॉन जो ० बंध बनाने में प्रयुक्त होते है तथा मजबूती से बन्धे रहते हैं ० इलेक्ट्रॉन कहलाते हैं। इसी प्रकार बन्ध बनाने में प्रयुक्त होने वाले इलेक्ट्रॉन कम मजबूती से बंधे रहते हैं इन्हें – इलेक्ट्रॉन कहते हैं। ये दोनों प्रकार के इलेक्ट्रॉन क्रमशः o बंधी कक्षक (o bonding orbitals) तथा बंधी कक्षक ( – bonding orbital) में पाये जाते हैं। कुछ इलेक्ट्रॉन किसी भी बन्ध में भाग नहीं लेते उन्हें बंधहीन अथवा अबन्धी (non-bonding) इलेक्ट्रॉन कहते हैं। कार्बनिक अणु में यदि ऑक्सीजन, नाइट्रोजन, सल्फर अथवा हैलोजन के परमाणु विद्यमान हों तो उनमें एकाकी इलेक्ट्रॉन युग्म (lone pairs of electrons) के रूप में अबन्धी इलेक्ट्रॉन उपस्थित रहते हैं। इन्हें n – इलेक्ट्रॉन कहते हैं।
अणु की मूल अवस्था में इलेक्ट्रॉन बन्धी कक्षकों में ऊर्जा अवशोषण कर उत्तेजित हो जाते हैं और विपरीत बन्धी कक्षकों में चले जाते हैं । ० एवं बन्धों से सम्बन्धित विपरीत बन्धी कक्षकों (अधिक ऊर्जा वाले कक्षकों) को * एवं * कक्षकों से प्रदर्शित करते हैं। n इलेक्ट्रॉन बंध बनाने में भाग नहीं लेते अतः इनसे सम्बन्धित कोई विपरीत बंधी कक्षक नहीं होता है। जब एक अणु पराबैंगनी एवं दृश्य क्षेत्रों में ऊर्जा का अवशोषण करता है तो इलेक्ट्रॉनिक ऊर्जा स्तरों में निम्नलिखित संक्रमण होते हैं।
ऊर्जा स्तरों में इलेक्ट्रॉनीय संक्रमण के प्रकार (Types of electronic transitions in energy levels)
(i) 0→ ०* संक्रमण- इस प्रकार का संक्रमण उन यौगिकों में होता है जिनमें ० इलेक्ट्रॉन हों । ० इलेक्ट्रॉन अणु में परमाणुओं के साथ अधिक मज़बूती से बंधे रहते हैं। अतः इस प्रकार के संक्रमणों के लिए अधिक ऊर्जा की आवश्यकता होती है। ऐसे संक्रमण के कारण अवशोषण बैण्ड दूर पराबैंगनी क्षेत्र (Far ultraviolet region) अर्थात कम तरंगदैर्घ्य वाले क्षेत्र में प्राप्त होता है। वे यौगिक जिनमें सभी संयोजी इलेक्ट्रॉन बंध बनाते हैं (अर्थात संतृप्त हाइड्रोकार्बन) में इस प्रकार का संक्रमण होता है। जैसे मेथेन 125 nm एवं एथेन 135 nm पर अवशोषण करते हैं।
(ii) n→o*-वे संतृप्त यौगिक जिनमें अबंधी इलेक्ट्रॉन वाले परमाणुओं से युक्त समूह एकल बंध से जुड़े हो, उनमें n * संक्रमण होते हैं। अबंधी इलेक्ट्रॉन रखने वाले परमाणु साधारणतया O, N, S और हैलोजन. आदि होते हैं। n * संक्रमणों में 0- 0* संक्रमणों की अपेक्षा कम ऊर्जा की आवश्यकता होती है। अतः अवशोषण पराबैंगनी क्षेत्र में अपेक्षाकृत ऊँची तरंगदैर्ध्य में होता है।
उदाहरणार्थ- ट्राइफेनिल ऐमीन, मेथिल ऐल्कोहॉल एवं मेथिल आयोडाइड में n * संक्रमण होता है तथा इसके लिए संगत का मान क्रमशः 227, 174 और 258 mm है।
कभी-कभी n एवं o* कक्षक उपलब्ध होने पर भी n * संक्रमण प्राप्त नहीं होता है जैसे- ट्राइमेथिलऐमीन जो किसी ध्रुवीय विलायक में अवशोषण बैंड प्रदर्शित करता है जलीय विलयन में * संक्रमण हाइड्रोजन बंध के कारण नहीं दर्शाता है ।
(iii) 7π → r* इस प्रकार का संक्रमण उन यौगिकों में होता है जिनमें – कक्षकों में इलेक्ट्रॉन होते हैं अर्थात यह असंतृप्त यौगिकों में होता है। जैसे ->c=c<,-c=c->c =Ö:, >C = N:,
— N = N— आदि |
Π – π* संक्रमण में एक π- इलेक्ट्रॉन उत्तेजित होकर π* विपरीत बंधी कक्षक में पहुँचता है। इस संक्रमण के लिए आवश्यक ऊर्जा n * संक्रमण के लिए आवश्यक ऊर्जा से कम परन्तु n * संक्रमण के लिए आवश्यक ऊर्जा से अधिक होती है। अतः ऐसे संक्रमण वाले यौगिक साधारणतया पराबैंगनी एवं दृश्य क्षेत्र में अवशोषण करते हैं। जैसे ऐथिलीन में π – π संक्रमण के संगत = 180nm हैं।
(iv) n→ π* इस प्रकार का संक्रमण उन यौगिकों में होता हे जिनमें अबन्धी एवं π दोनों प्रकार के इलेक्ट्रॉन विद्यमान होते हैं। इस प्रकार के संक्रमण में एकाकी इलेक्ट्रॉन युग्म में से एक इलेक्ट्रॉन उत्तेजित होने पर π* विपरीत बंधी कक्षक में पहुँचता है। उदाहरणार्थ – > C = O: समूह वाले यौगिक से 279 nm पर प्राप्त बैंण्ड n = π* संक्रमण के कारण है।
0 →π * एवं π → ०* दोनों संक्रमण सममिति अनुमत (Symmetry forbidden ) नहीं है। इन्हें निषिद्ध संक्रमण (forbiddon transition) कहते हैं।
वर्णमूलक या क्रोमोफोर (Chromophore)
किसी यौगिक का रंग उसमें उपस्थित एक या अधिक असंतृप्त समूहों के कारण होता है। इन समूहों वर्णमूलक या क्रोमोफोर कहते हैं। ये पराबैंगनी एवं दृश्य क्षेत्रों में अभिलक्षणिक अवशोषण प्रदर्शित करते हैं। वर्णमूलक (chromophore ) एक वियुक्त क्रियात्मक समूह ( isolated functional group) है जो किसी अन्य समूह के साथ संयुग्मन (conjugation) में न हो और जो दृश्य एवं पराबैंगनी क्षेत्रों में अपनी अभिलक्षणिक तरंगदैर्घ्य को अवशोषित करके यौगिक को रंग प्रदान करे।
वर्णमूलक दो प्रकार के होते हैं-
(i) ऐसे वर्णमूलक जिनमें इलेक्ट्रॉन होते हैं जो π – π संक्रमण करते हैं जैसे- एथिलीन (>c = c< ), ऐसीटिलीन (-C=C-) आदि ।
(ii) ऐस वर्णमूलक जिसमें π इलेक्ट्रॉन एवं n – इलेक्ट्रॉन होते हैं, वे दो प्रकार संक्रमण (अ)π → π * (ब) n → π * प्रदर्शित करते हैं। जैसे – कार्बोनिल (>C=O), थायोकार्बोनिल (>C=S), ऐजो (- N=N−), नाइट्रो (–NO2) आदि ।
वर्णमूलकों के कुछ प्रतिरूपी उदाहरण- >C = C<,-C=C-, >C=O,-N=N,C=S,-N=Oआदि हैं जो रंग प्रदान करने की क्षमता के आरोही क्रम में लिखें गए हैं।
इन सभी से इलेक्ट्रॉन दृढ़ता से बँधे नहीं होते हैं तथा इलेक्ट्रॉनों के ऊर्जा स्तर काफी निकट होते हैं। विभिन्न ऊर्जा स्तरों में बहुत कम अन्तर होता है। अतः ये दृश्य एवं पराबैंगनी विकिरणों का अवशोषण कर लेते हैं और अवशोषित ऊर्जा से अपने इलेक्ट्रॉनों को उच्च ऊर्जा स्तर में स्थानान्तरित कर देते हैं। इस कारण दृश्य विकिरणों का अवशोषण करने वाले यौगिक (वर्णमूलक समूहों की उपस्थिति के कारण) रंगीन नजर आते हैं । क्रियात्मक समूह में यदि असंतृप्त बंधों (unsaturated bonds) को एकल बंध (single bond) द्वारा पृथक किया जाता है तो अवशोषण और भी प्रबल हो जाता है। इसे संयुग्मन (conjugation) कहते हैं। यह संयुग्मन नए वर्णमूलकों की उत्पत्ति करता है । वर्णमूलक के साथ संलग्न अन्य संरचनाओं एवं विलायक के प्रभाव भी इसमें परिवर्तन आ जाता है।
वर्णवर्धक (Auxochromes)
ऐसे समूह जो स्वयं किसी यौगिक को रंग प्रदान नहीं करते परन्तु किसी वर्णमूलक के साथ जुड़कर उसकी रंग प्रदान करने की क्षमता बढ़ा देते हैं वर्णवर्धक (auxochrome) कहलाते हैं। ये समूह 2000 A से नीचे अपना अभिलाक्षणिक अवशोषण प्रदर्शित करते हैं। जब ये किसी वर्ण मूलक के साथ जुड़े हुए होते हैं तो अवशोषण को उच्चतर तरंगदैर्ध्य की ओर खिसका देते हैं। वर्णवर्धक अवशोषण की तीव्रता को बढ़ा देते हैं। उदाहरण के लिए ट्रांस ऐजोबेन्जीन के अवशोषण की तुलना में ट्रान्स – p-एथॉक्सी ऐजोबेंजीन का अभिलाक्षणिक अवशोषण लम्बी तरंगदैर्घ्य की ओर 650A से विस्थापित होता है एवं लगभग दुगुनी तीव्रता का होता है। वर्णवर्धकों के प्रारूपिक उदाहरण – OH, NH2, NHR, NR2, OR, CH3, Br आदि हैं। सभी वर्णवर्धकों मे अबंधी इलेक्ट्रॉन होते हैं। वर्णवर्धक की क्रिया इन अबंधी इलेक्ट्रॉनों के इलेक्ट्रॉनीय संक्रमण के कारण होती है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics