cell constant in hindi सेल स्थिरांक किसे कहते हैं किसी चालकत्व सेल का सेल-स्थिरांक होता है
cell constant in hindi सेल स्थिरांक किसे कहते हैं किसी चालकत्व सेल का सेल-स्थिरांक होता है ?
चालकत्व का मापन (Measurement of Conductance)
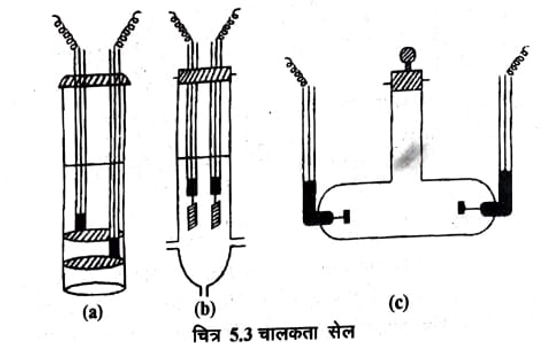
प्रतिरोध का व्यक्क्रम चालकत्व होता है अतः किसी विलयन का चालकत्व ज्ञात करने के लिए उस विलयन का प्रतिरोध ज्ञात कर लिया जाता है। प्रतिरोध मापने के लिए प्रायः व्हीटस्टोन ब्रिज (Wheatstone bridge) विधि का प्रयोग किया जाता है। जिस विलयन का चालकत्व ज्ञात करना होता है उसे एक विशेष प्रकार के सेल चित्र (5.3) में ले लिया जाता है जिसे चालकता सैल (Conductivity cell) कहते हैं। (चित्र 5.3 (a) में अल्प चालकता वाले विलयनों के लिए तथा चित्र 5.3 (b) तथा 5.3 (c) में उच्च चालकता वाले विलयनों के लिए प्रयुक्त सेलों को दिखाया गया है। )
चालकता सेल चालकता सैल में प्लेटिनम की प्लेट इलेक्ट्रोड का कार्य करती है। यह प्लेटिनम की प्लेट सूक्ष्म विभाजित प्लेटिनम की परत होती है यह प्लेट प्लेटिनम के तारों के साथ वेल्ड की हुई रहती है। इन नलियों में पारा भरा रहता है तथा वे सेल के एबोनाइट खोल में मजबूती से जकड़ी रहती है। जिससे प्रयोग के दौरान इलेक्ट्रोडों के बीच की दूरी स्थिर रहती है। प्लेटिनम के साथ सम्पर्क परिपथ के ताबें के तारों को नलियों में भरे पारे में डूबो कर स्थापित किया जाता है। इसमें विद्युत धारा प्रवाहित करके प्रतिरोध का मापन कर लिया जाता है। इस विधि में धारा के चालन के साथ-साथ विलयन का वैद्युत अपघटन भी हो जाता है। जिससे निम्न दो कठिनाइयाँ उत्पन्न हो जाती हैं-
(i) विलयन के सान्द्रण में परिवर्तन आ जाता है।
(ii) इलेक्ट्रोडों पर उत्पादों के इक्ट्ठा होने से ध्रुवण (Polarisation) (विरोधी विद्युत वाहक बल) होता है तथा धारा में अवरोध उत्पन्न होने के कारण प्रतिरोध में परिवर्तन हो जाता है। इन कठिनाइयों को दूर करने के लिए दिस्ट धारा (Direct Current) के स्थान पर प्रत्यावर्ती धारा (Alternating Current) का प्रयोग करते है तथा व्हीटस्टोन ब्रिज परिपथ में गेल्वेनोमीटर के स्थान पर
व्हीटस्टोन ब्रिज हेड् फोन (Head phone) अथवा मेजिक आई (Magic Eye) का उपयोग करते हैं। (चित्र 5.4) विद्युत अपघटनी विलयन के चालकत्व के निर्धारण के लिए प्रयुक्त उपकरण को चित्र 5.5 में दिखाया गया है।
उपकरण में AB एक समान मोटाई का प्लेटीनम इरीडियम मिश्र धातु या मैगनिन का तार है जो मिलिमीटर में अशांकित मीटर पैमाने के ऊपर तना हुआ खिंचा रहता है। इस तार पर एक सर्पीसम्पर्क X (sliding contact) चलता है। व्हीटस्टोन ब्रिज के साथ एक प्रतिरोध बॉक्स R जो कि ब्रिज की एक भुजा का कार्य करता है तथा एक चालकता सेल C लगा रहता है जिसमें विलयन भरा जाता है। इस सेल को एक ताप स्थापी (Thermo state) में रखते हैं ताकि ताप स्थिर रहे, यह ब्रिज की दूसरी भुजा का कार्य करता है। T एक हैडफोन है जो धारा का पता लगाता है। I एक प्रेरण कुण्डली है जिससे धारा प्रवाहित की जाती है।
जब धारा प्रवाहित की जाती है तो प्रतिरोध बॉक्स R में से किसी प्रतिरोध को निकाल देते हैं और सर्पी सम्पर्क X को चलाकर वह बिन्दु ज्ञात कर लेते हैं जिस पर हैड फोन में आने वाली आवाज न्यूनतम (सबसे कम) हो। ऐसी स्थिति में ब्रिज संतुलित हो गया तब उस बिन्दु को पढ़ लेते हैं, माना कि वह बिन्दु X है इस बिन्दु को संतुलन बिन्दु ( equivalence point) कहते हैं। पैमाने पर AX तथा BX की लम्बाई ज्ञात कर निम्न प्रकार से प्रतिरोध की गणना करते हैं।
प्रतिरोध बॉक्स R में से ऐसे प्रतिरोध की डाट निकालनी चाहिए जिससे कि संतुलन बिन्दु या शून्य विक्षेप स्थिति (null point) तार AB के लगभग मध्य स्थान पर आये ताकि यथार्थ मान परिणाम प्राप्त हो सके। प्रतिरोध R लम्बाई BX और AX के मान ज्ञात होने पर सेल में लिये गये विलयन का प्रतिरोध निकाल सकते हैं। इस विलयन का प्रतिरोध का व्युत्क्रम विलयन की चालकत्व होगी। आजकल जो अच्छी किस्म के उपकरण काम में लिए जाते हैं उनमें संतुलन बिन्दु या शून्य विक्षेप स्थित ज्ञात करने के लिए कैथोड किरण ऑसीलोस्कोप (Cathod Ray Oscilloscope) या मैजिक आई (Magic Eye) लेते हैं।
सैल स्थिरांक (cell constant in hindi ) भौतिक रसायन भाग- ।।
जैसा कि पहले बताया जा चुका है कि चालकता पदार्थ के एक घन सेमी विलयन की चालकत्व होती है। इसलिए उपरोक्त विधि में मापी गई चालकत्व केवल तभी चालकता होगी जबकि इलेक्ट्रोड ठीक एक सेमी दूर तथा इनका क्षेत्रफल भी एक वर्ग सेमी. हो लेकिन प्रायः ऐसा नहीं होता इसलिए चालकता के ठीक मान की गणना करने के लिए प्राप्त चालकत्व को किसी गुणाक से गुणा करना पड़ता है जो सेल स्थिरांक कहलाता है। अर्थात यदि इलेक्ट्रोड के बीच की दूरी/सेमी उनके अनुप्रस्थ परिच्छेद का क्षेत्रफल A वर्ग सेमी तथा विलयन का प्रतिरोध R हो तो
अतः सैल स्थिरांक वह गुणक है जिसे विलयन के प्रेक्षित चालकत्व (C) से गुणा करने पर चालकता प्राप्त होती है।
सेल स्थिरांक का निर्धारण (Determination of Cell Constant )– चूंकि इलेक्ट्रोडों का क्षेत्रफल और उनके बीच की दूरी ज्ञात करना कठिन है अतः सेल स्थिरांक परोक्ष विधि (Indirect Method) द्वारा निर्धारित किया जाता है।
विभिन्न सान्द्रता और ताप पर पोटेशियम क्लोराइड विलयन की चालकता के प्रामाणिक मान सारणी 5.2 में दिये गये हैं।-
सेल स्थिरांक के निर्धारण के लिए पोटेशियम क्लोराइड के ऐसे विलयन जिसका विशिष्ट चालकत्व सही सही ज्ञात है को प्रयोगात्मक चालकता सेल में लिया जाता है और व्हीटस्टोन ब्रिज विधि द्वारा विलयन की चालकता ज्ञात करली जाती है । दिए हुए चालकता के सेल स्थिरांक की गणना निम्न सूत्र से करते हैं
सेल स्थिरांक का मान एक बार ज्ञात हो जाने पर किसी भी विलयन की चालकता का निर्धारण विलयन को इस सेल में भरकर उसका चालकत्व (प्रतिरोध) ज्ञात कर उसे सेल स्थिरांक से गुणा करते हैं।
विद्युत अपघट्य विलयनों की सही-सही चालकता निर्धारण के लिए विलयनों को एक विशेष प्रकार शुद्ध किए गए जल जिसे चालकता जल (Conductivity Water) कहते हैं में तैयार किया जाता है । अशुद्ध जल में अशुद्धियों के आयनों के चालकता में योगदान के कारण साधारण जल की पर्याप्त चालकता होती है। अतः किसी विद्युत अपघट्य की सही चालकता निकालने के लिए उसकी प्रेक्षित चालकता में से जल की चालकता घटानी होगी। कोलराऊश और हेडवीलर द्वारा प्राप्त अधिक से अधिक शुद्ध चालकता मापी जल की 25° से. पर चालकता 5.8×10 ओम 1 सेमी. – 1 है। चालकता मापी
जल को तैयार करने के लिए आसुत जल को थोड़ी KMnO4 की मात्रा के साथ आसवन उपकरण में आसवन कराया जाता है। आसवित जल चालकता मापी जल है ।
चालकत्व पर तनुता का प्रभाव (Effect of Dilution on Conductance) किसी विलयन की विशिष्ट और तुल्यांकी चालकताऐं आयनों की संख्या पर निर्भर करती है अतः स्पष्ट है कि ये विलयन की सान्द्रता पर निर्भर करती है। किसी विलयन की चालकता उसमें उपस्थित आयनों की संख्या के समानुपाती होती है अतः विलयन को तनु करने पर विद्युत अपघटय् की वियोजन… की मात्रा बढ़ जाती है जिससे विलयन में आयनों की संख्या बढ़ जाती है। तथा अन्तरा आयनिक बल तथा विस्कासिता घटती है। विलयन को तनु करने पर इसकी चालकता घट जाती है क्योंकि चालकता एक घन सेमी. विलयन में उपस्थित आयनों की संख्या पर निर्भर होती है। जब विलयन तनु किया जाता है तो वियोजन की मात्रा बढ़ती है, परिणामस्वरूप आयनों की कुल संख्या में वृद्धि की अपेक्षा विलयन के आयतन में वृद्धि अधिक अनुपात में होती है। अर्थात प्रति मिलि आयनों की संख्या घटती है जिससे चालकता भी घटती जाती है। सारणी 5.3 में 25° से. पर KCI विलयन की विभिन्न सान्द्रता पर विशिष्ट एवं तुल्यांकी चालकता के मान दिये गये हैं।
विलयन को तनु करने पर उसकी तुल्यांकी या आण्विक चालकता में वृद्धि होती है चूंकि इसको तनु करने पर एक ग्राम तुल्यांकी अथवा एक ग्राम अणु विद्युत अपघट्य रखने वाले विलयन का आयतन (V) बढ़ता है जबकि अपेक्षाकृत चालकता में कमी कम अनुपात में होती है। इसलिए तुल्यांकी चालकता (A) जो 2x V का गुणनफल है, बढ़ती है। तुल्यांकी व आणविक चालकताएँ तनुकरण करने पर लगातार तब तक बढ़ती है जब तक की इसका उच्चतम मान नहीं हो जाता। इसके आगे तनुकरण करने पर तुल्यांकी व आणविक चालकता में कोई परिवर्तन नहीं होता है। इन चालकताओं का उच्चतम मान चरम मान या अनन्त तनुता पर तुल्यांकी या आणविक चालकता (Equivalent or molecular conductance at infinite dilution) कहलाती है। इन्हे क्रमशः प्रदर्शित करते है।. इस अवस्था में विद्युत अपघट्य का आयनन पूर्ण हो जाता है और तनुकरण के साथ चालकता में कमी उसी अनुपात में होती है जिस अनुपात में एकं ग्राम तुल्यांक विद्युत अपघट्य रखने वाले विलयन के आयतन में वृद्धि होती है ताकि गुणनफल K x V अपरिवर्तित रहे। अतः तुल्यांकी व आणविक चालकता भी परिवर्तित नहीं होती है बल्कि स्थिर रहती है।
आयनों का अभिगमन एवं कोलराऊस का नियम (Migration of lons and Kohlrausch’s Law)
दुर्बल विद्युत अपघटयों के का मान ज्ञात करने के लिए आलेख बहिर्वेशन विधि काम में नहीं लायी जा सकती है। अतः इसका मान निर्धारित करने के लिए आयनों के स्वतन्त्र अभिगमून का कोलराऊश नियम उपयोग में लिया जाता है। (Kohlrausch’s law of Independent Migriation of Ions) कुछ युग्मों की जिनमें धनायन या ऋणायन उभयनिष्ठ हो, ऐसे विद्युत अपघटयों की अनन्त तनुता पर तुल्यांकी चालकताओं के मान सारणी 5.4 में दिए है।
सारणी 5.4: 25° (298K) से. पर विद्युत अपघटयों के विभिन्न युग्मों की अनन्त तनुता पर तुल्यांकी चालकताऐं (ओम 1 सेमी 2 तुल्यांक – 1)
उपरोक्त सारणी से स्पष्ट है कि दिये हुए ताप पर उभयनिष्ठ आयन (common ion) रख विद्युत अपघटयों की अनन्त तनुता पर तुल्यांकी चालकताओं में अन्तर निश्चित ( constant ) है । उदाहरणार्थ- समान ऋणायन के साथ K+ तथा Li+ आयन रखने वाले विद्युत अपघटयों के लिए का अन्तर 34.83 है । इसी प्रकार समान धनायन के साथ CI- और NO, – रखने वाले विद्युत अपघट के लिए का अन्तर 4.90 है।
के अन्तर में यह स्थिरता तभी सम्भव है जब विद्युत अपघट्य के प्रत्येक आयन विलयन की तुल्यांकी चालकता में एक निश्चित योगदान करता है। यह योगदान अन्य आयन जिसके साथ वह बन्ध है, पर निर्भर नहीं करता है। कोलरॉऊस (1875) ने इस प्रकार बताया है कि अनन्त तनुता पर विद्युत अपघट्य का आयनन पूर्ण हो जाने से सभी अन्तर आयनी आकर्षण (inter ionic attraction) समाप्त हो जाते हैं। जिससे आयनों के बीच कोई अनोन्य क्रिया होने की सम्भावना नहीं रहती, इसलिए विद्युत अपघट्य से उत्पन्न सभी आयन विद्युत अपघट्य विलयन की कुल तुल्यांकी चालकता में अपने हिस्से का एक निश्चित योगदान करता है जो कि केवल उसकी प्रकृति पर निर्भर है और उसके सहआ (co-ion) की प्रकृति पर निर्भर नहीं करता है। इससे कोलराऊस ने एक नियम प्रतिपादित किया जिसे आयनों के स्वतन्त्र अभिगमन का कोलराऊस नियम (Kohlrausch’s law of Independent migration of ions) या कोलराऊस का आयनों के स्वतन्त्र अभिगमन का नियम कहते हैं।
इसके अनुसार किसी भी विद्युत अपघट्य की अनन्त तनुता पर तुल्यांकी चालकता उसके अवयवी आयनों की आयनिक चालकताओं के योग के बराबर होती है। इस प्रकार
जहाँ (ओम’ सेमी 2 मोल-1 तथा λ°°a क्रमशः λ°°c अनन्त तनुता पर धनायनों और ऋणायनों की चालकताएँ हैं। इन्हें मोलर आयनिक चालकतायें भी कहते हैं। जैसे- से. पर कुछ धनायनों व ऋणायनों की अनन्त तनुता पर मोलर चालकताएँ दी गई है।
NaCl के लिए एक तुल्यांक बराबर है एक मोल के जबकि CaCl2 के लिए एक तुल्यांक बराबर 1/2 मोल Ca2+ आयन तथा 1 मोल CH- आयन एक मोल CaCh एक मोल Ca2+ आयन तथा दो मोल CI-आयन देता है जिसमें आयन का आवेश क्रमशः + 2 व 1 होता है। इसी प्रकार Na2SO4 के लिए हम निम्न प्रकार लिखते है। =
अनन्त तनुता पर मोलर चालकता के सन्दर्भ में कोलराऊस की समीकरण
जहाँ v+ व v_ क्रमशः धनायनों व ऋणायनों की संख्या है जो उस विद्युत अपघट्य के एक मोल के वियोजन से बनते हैं। मोलर चालकताओं के रूप में