बीयर-लैम्बर्ट नियम का सत्यापन करना गणितीय निरूपण है beer’s law mathematical expression in hindi
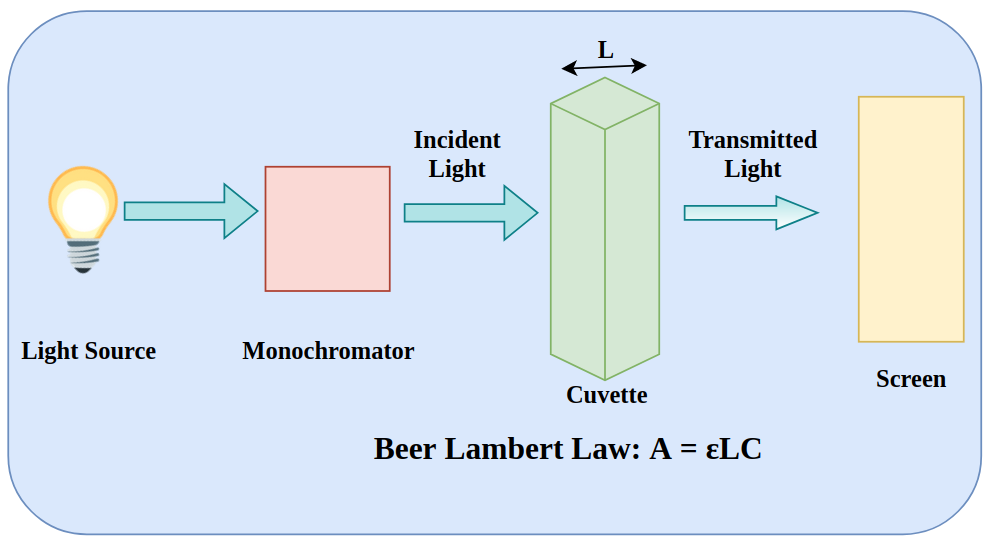
beer’s law mathematical expression in hindi equation example बीयर-लैम्बर्ट नियम का सत्यापन करना गणितीय निरूपण है ?
बीयर का नियम ( Beer’s Law)
लैम्बर्ट के नियमानुसार प्रकाश का अवशोषण परत की मोटाई पर निर्भर करता है। लेकिन मात्रात्मक विश्लेषण में हम विलयन लेते हैं। यदि अवशोषक माध्यम एक तनु विलयन के रूप में हो तो आपति व पारगम्य प्रकाश की तीव्रताओं में क्या सम्बन्ध होगा अर्थात् यौगिक की सान्द्रता का प्रकाश के अवशोषण पर पड़ने वाले प्रभाव का अध्ययन बीयर ने किया। बीयर के अनुसार जब कोई समानान्तर एक वर्णी प्रकाश की किरण पुंज किसी तनु विलयन (समांगी माध्यम) में प्रवेश करती है तो अवशोषणांक या विलोप गुणांक विलयन की सान्द्रता का समानुपाती होता है। अर्थात्
जहां विलयन की सान्द्रता तथा K’ समानुपाती स्थिरांक (नियंतांक) है जो विकिरण के तरंगदैर्धा प्रकृति तथा विलयन की परत की मोटाई पर निर्भर करता है।
बीयर नियम भी लैम्बर्ट नियम के अनुसार ही है केवल अन्तर इतना है कि लैम्बर्ट नियम में अवशोषण परत की मोटाई पर निर्भर करता है जबकि बीयर नियम में विलयन की सान्द्रता पर निर्भर करता है।
बीयर लैम्बर्ट नियम ( Beer Lambert Law)
यह नियम बीयर व लैम्बर्ट के नियम का संयुक्त रूप है। इसे कभी कभी केवल बीयर नियम से भी जाना जाता है। इसके अनुसार आपतित प्रकाश का अवशोषित भाग, प्रकाश द्वारा तय किय गए पथ में उपस्थित अणुओं की संख्या के समानुपाती होता है। यदि अवशोषक पदार्थ विलयन है तो प्रकाश के पथ में अणुओं की संख्या विलयन की सान्द्रता (ग्राम मोल प्रति लिटर) तथा पथ की मोटाई x सेमी. के समानुपाती होती है। बियर लैम्बर्ट नियम को गणितीय रूप में इस प्रकार लिख सकते हैं-
जहां (एपसाइलन) एक नियतांक है जिसे आणविक या मोलर विलोप गुणांक या मोर विलोपन गुणांक (Molar Extinction Coefficient) या ग्राम अणुक अवशोषण क्षमता (MolarAsorpti or Molar Absorbancy) कहते हैं। यदि c= 1 ग्राम अणु प्रति लिटर व x = 1 सेमी. हो तो समीकरण (14) से स्पष्ट है कि-
ऐसी स्थिति में ∈ का मान अवशोषणांक या विलोप (विलोपन) गुणांक के समान होता है। अतः मोल अवशोषकता या मोलर विलोप गुणांक ∈ एक इकाई ग्राम अणुक सान्द्रता के विलयन की एक सें. मी. मोटी परत द्वारा उत्पन्न विलोपन या अवशोषणांक के बराबर होता है। प्रकाश की निश्चित तरंग दैर्ध्य तथा स्थिर ताप पर यह किसी यौगिक के लिए अभिलाक्षणिक गुण (Characteristic property) है ।
पारगम्यता (Transmittance) : अवशोषणांक (A), पारगम्यता (T) व मोलर अवशोषण गुणांक या मोलर विलोपन गुणांक में निम्न सम्बन्ध है।
बीयर लैम्बर्ट नियम की सीमायें (Limitations of Beer Lambert Law) बीयर का नियम प्रसामान्य रूप से वैध पाया गया है। किन्तु निम्नलिखित परिस्थितियों में इस नियम का पूर्ण रूप से पालन नहीं होता है अर्थात् इस नियम से विचलन होने लगता है-
(1) यदि प्रकाश एक तरंगदैर्ध्य का न होकर कई तरंगदैर्ध्य का हो तो नियम का ठीक से पालन नहीं होता । अतः प्रकाश की एक वर्णी (monochromatic) विकिरण की समान्तर किरण पुंज का उपयोग करना चाहिए।
(2) विलयन की तनुता के साथ अवशोषक अणुओं की प्रकृति में परिवर्तन नहीं होना चाहिए। तनुता बढ़ाने पर अवशोषण करने वाली स्पीशीज की प्रकृति में परिवर्तन, जल अपघटन, आयनन, संगुणन, हाइड्रोजन बन्ध, विलायक संगुणन, विलेय की प्रतिदीप्ति, विलायक की अल्प पारगम्यता आदि कारणों से होते हैं।
(3) विलेय का स्कन्दन (Coagulation) नहीं होना चाहिए।
(4) ∈ का मान ताप पर भी निर्भर करता है अतः ताप स्थिर होना चाहिए।
(5) इस नियम का पालन तनु विलयनों के लिए होता है अतः विलयन की सान्द्रता अधिक नहीं होनी चाहिए।
इस प्रकार स्पेक्ट्रोफोटोमितीय ( Spectrophotometric) अध्ययन में विलेय की सम्पूर्ण सान्द्रता परास के लिए उपरोक्त सीमाओं को ध्यान में रखते हए बीयर लैम्बर्ट नियम की पुष्टि कर लेने के बाद ही आगे बढ़ना चाहिए। इस नियम की पुष्टि हेतु विलेय की सान्द्रता और विलोपन गुणांक के बीच ग्राफ खींचने पर मूल बिन्दु से गुज़रती हुई सरल रेखा प्राप्त होनी चाहिए। अर्थात् जब सान्द्रता बढ़ाने पर सरल रेखा आना बन्द हो जाये तो आगे की सान्द्रता के लिए यह वैध नहीं है।
प्रकाश रसायन के नियम (Law of Photo- Chemistry)
प्रकाश रसायन के दो मूलभूत नियम है।
ग्रोथस ड्रेपर का नियम (Grothuss Draper’s Law) प्रकाश रसायन का यह मूलभूत नियम है इसे सर्वप्रथम 1818 में ग्रोथस व ड्रेपर ने प्रकाश रासायनिक अभिक्रियाओं के गुणात्मक व मात्रात्मक अध्ययन के आधार पर प्रतिपादित किया इसके अनुसार जब प्रकाश विकिरण पदार्थ पर गिरता है तब आपतित विकिरण का वह भाग जो अवशोषित करता है रासायनिक परिवर्तन करता है न कि विकिरण का परावर्तित (reflected) या पारगत (transmitted) भाग ।
अर्थात् रासायनिक अभिक्रिया या परिवर्तन केवल उन्हीं प्रकाश विकिरणों द्वारा सम्पन्न होती है जिनका अभिकारकों या निकाय द्वारा अवशोषण होता है।
इसका अर्थ यह हुआ कि निकाय या अणु विकिरण के फोटॉन के अवशोषण से ऊर्जा प्राप्त करते हैं। लेकिन हमेशा यह आवश्यक नहीं है कि अवशोषित प्रकाश विकिरण से सदैव रासायनिक अभिक्रिया घटित ही हो। कई बार अवशोषित प्रकाश से कोई रासायनिक अभिक्रिया घटित भी नहीं होती है जैसे पौटेशियम डाइक्रोमेट का विलयन विकिरण के एक भाग का अवशोषण तो करता है लेकिन रासायनिक परिवर्तन नहीं होता। ऐसी अवस्था में अवशोषित विकिरण ऊर्जा या तो अवशोषित अणुओं की गतिज ऊर्जा को बढ़ा देती है जिससे ऊष्मीय ऊर्जा या भिन्न तरंगदैर्घ्य विकिरण के रूप में मुक्त होती है। कई प्रयोगों में ये प्रतिदिप्ती (Fluorescence) या स्फुरदिप्त (phosphorescence) के रूप में मुक्त होती है। अतः यह नियम एक गुणात्मक नियम है तथा अवशोषित होने वाले प्रकाश की मात्रा (तीव्रता ) व अभिक्रिया करने वाले अणुओं की संख्या में कोई मात्रात्मक सम्बन्ध नहीं बताता है।
स्टार्क आइन्सटाइन नियम या प्रकाश रासायनिक तुल्यता का नियम (Stark Einstein Law or Law of Photo Chemical Equivalence)
सन् 1912 में स्टार्क तथा आइन्सटीन ने प्रकाश रासायनिक अभिक्रियाओं का मात्रात्मक अध्ययन किया तथा प्रकाश रसायन का दूसरा नियम क्वाटम सिद्धान्त के आधार पर दिया इसे प्रकाश रासायनिक तुल्यता का नियम या स्टार्क आइन्सटीन नियम कहते हैं।
इसके अनुसार, क्रियाकारी पदार्थ का प्रत्येक अणु जो प्रकाश रासायनिक क्रिया में भाग लेता है एक फोटान या प्रकाश का एक क्वांटम अवशोषित कर सक्रियित होता है अर्थात् एक अणु एक फोटॉन या एक क्वाटम अवशोषित कर सक्रियित होता है अर्थात् “एक अणु एक क्वांटम” (One molecule one quantum).
एक फोटान (या एक क्वाटम) का अर्थ है hv के बराबर ऊर्जा जहां h प्लांक स्थिरांक है तथा v अवशोषित विकिरण की आवृत्ति । अतः पदार्थ के द्वारा प्रतिमोल अवशोषित होने वाली ऊर्जा
जहां N आवोगेद्रो संख्या है।
E=Nhv
पदार्थ के प्रति मोल द्वारा अवशोषित ऊर्जा (E) “आइन्सटीन” (Einstein) कहलाती है।
प्रकाश ऊर्जा के एक मोल की ऊर्जा एक क्वांटम (hv) कहलाती है। अतः फोटान और क्वांटम भी ऊर्जा की इकाईयों के रूप में प्रयुक्त होते हैं। चूंकि एक अणु एक फोटान या एक क्वांटम अवशोषित करता है अतः पदार्थ के एक मोल द्वारा अवशोषित ऊर्जा भी एक आइन्सटाइन कहलायेगी । व्यंजक (A) व (B) से स्पष्ट है कि ऊर्जा तरंगदैर्घ्य के व्युत्क्रमानुपाती है
अतः इससे स्पष्ट है कि प्रकाश के कम तरंगदैर्ध्य पर ऊर्जा अधिक होगी। उपरोक्त परिभाषा से सक्रियित ( activated) शब्द का अर्थ सिर्फ भौतिक रूप से उत्तेजित (excited) अणु से ही है न कि रासायनिक रूप से सक्रिय अणु
वस्तुत एक अणु एक फोटॉन का अवशोषण कर सक्रियित होता है और प्रत्येक सक्रियत अणु क्रिया कर उत्पाद दे यह अनिवार्य नहीं है। प्रकाश रासायनिक तुल्यता नियम को “क्वांटम सक्रियण सिद्धान्त” (Principle of Quantum Activation) भी कहा जाता है।
जेबालास्की आरेख (Jablonski Diagram)
प्रकाश रासायनिक अभिक्रिया में क्रियाकारी अणु द्वारा प्रकाश के फोटान या क्वाटम के अवशोषण तथा उसके बाद होने वाले विभिन्न प्रकाश भौतिकी एवं प्रकाश रासायनिक प्रक्रमों को समझना आवश्यक है। इसको जेबालास्की आरेख (Jablanski Diagram) द्वारा प्रदर्शित करते हैं।
चित्र को समझने से पूर्व इसमें कुछ पद काम में आते हैं उन्हें समझना आवश्यक है। अणु की मूल अवस्था (ground state) को So द्वारा प्रदर्शित करते हैं। जो कि उस अणु में उपस्थित इलेक्ट्रॉनों के कुल चक्रण को प्रदर्शित करते हैं। अधिकांश अणुओं की मूल अवस्था में सम इलेक्ट्रॉन (even electrons) होते हैं जो चक्रण युग्मित (spin paired ) होते हैं तथा चक्रण अवस्था ज्ञात करने के लिए (2S + 1) सूत्र का उपयोग करते हैं। जहां S इलेक्ट्रॉन के कुल चक्रण को प्रदर्शित करता है। अतः इस पद को उस अवस्था की चक्रण बहुलता (spin multiplicity) कहते हैं। चक्रण अवस्था ज्ञात करने के लिए जब इलेक्ट्रॉन युग्मित (14) हो तो
अतः अणु की चक्रण बहुलता 1 होगी। इसको यह भी कह सकते हैं कि अणु एकक मूल अवस्था (Singlet ground state) में हैं।
चक्रण अवस्था ज्ञात करने के लिए ( 25 + 1) सूत्र में कुल चक्रण S का मान रखने पर यदि मान 1 प्राप्त हो तो अवस्था एकक अवस्था (Singlet state) होगी तथा यदि मान 3 प्राप्त होता है तो अवस्था त्रिक अवस्था (Triplet state) कहलायेगी ।
अणु द्वारा फोटान के रूप में ऊर्जा अवशोषित करने पर इलेक्ट्रानीय संक्रमण में रासायनिक बंध के इलेक्ट्रॉन युग्म में से एक इलेक्ट्रॉन उत्तेजित अवस्था में चला जाता है यह दो प्रकार से संभव है। उत्तेजित इलेक्ट्रॉन का चक्रण साथ वाले इलेक्ट्रॉन के समानान्तर (Parallel) या विपरित (Anti parallel) हो सकता है। जैसा चित्र 7.3 (b) व (c) में दिखाया गया है। यदि उत्तेजित इलेक्ट्रॉन का चक्रण समानान्तर हो तो ( चित्र (b))
अतः अणु की चक्रण बहुलता (spin multiplity) 3 होगी। इसको इस प्रकार भी कह सकते हैं कि अणु त्रिक उत्तेजित अवस्था (triplet excited state) T में है । इसी प्रकार यदि चक्रण विपरीत (anti parallel) चित्र (c) हो तो
अतः अणु की चक्रण बहुलता 1 होगी। इसको इस प्रकार भी कह सकते हैं कि अणु एकक उत्तेजित अवस्था (singlet excited state) S में है।
अतः ‘S0 अणु की मूल एकक अवस्था (Ground singlet state) को प्रदर्शित करता है तथा S1, S2 S3………..S4. क्रमश प्रथम, द्वितीय एवं तृतीय आदि इलेक्ट्रॉनीय रूप से उत्तेजित एकक अवस्थाऐं (excited singlet state) हैं। इसी प्रकार T1, T2, T3………Tn आदि क्रमशः प्रथम, द्वितीय, तृतीय आदि उत्तेजित त्रिक अवस्थाऐं (Tripled excited state) है।
अधिकांशतः इलेक्ट्रॉनीय संक्रमण एकक मूल अवस्था (So) से एकक उत्तेजित अवस्थाओं (S1 or S2) में होते हैं।
क्वांटम यांत्रिकी से यह बताया जा चुका है कि एकक उत्तेजित अवस्था की ऊर्जा त्रिक उत्तेजित अवस्था से अधिक होती है। अतः ऊर्जा का क्रम इस प्रकार होगा:
प्रकाश फोटान के अवशोषण पर अवशोषित अणु का इलेक्ट्रॉन So से S1. S2 या S3 एकक उत्तेजित अवस्था में आ जाता है यह अवशोषित फोटान की ऊर्जा पर निर्भर करेगा । (चित्र 7.2)
अणु एकक उत्तेजित अवस्थायें या त्रिक उत्तेजित अवस्था में हो उसे सक्रिय (activated) अणु कहते हैं । अर्थात्
Ao+hv → A*
जहाँ A॰ अणु मूल अवस्था में तथा A* उत्तेजित अवस्था में है इसे सक्रिय अणु कहते हैं । सक्रिय या उत्तेजित अणु वापस अपनी मूल अवस्था में ऊर्जा को निकालते हुए निम्न प्रक्रमों द्वारा आता है। 7.7 विकिरण रहित संक्रमण उत्सर्जन (Non radiative transitions)
इस प्रकार के संक्रमणों में सक्रिय अणु उच्च उत्तेजित अवस्था ( S3, S2 या T3, T2) से प्रथम उत्तेजित अवस्था (S) या T) में आता है। इस प्रकार के संक्रमण में किसी प्रकार के विकिरणों का उत्सर्जन नहीं होता है इसलिए इन्हें विकिरण रहित (Non radiative or radiationless) संक्रमण (अनुत्सर्जन) कहते हैं। इसमें सक्रिय अणु की ऊर्जा अणुओं के संघटन (collision) से ऊष्मा के रूप में उत्सर्जित होती है। इस प्रकार को हम आन्तरिक रूपान्तरण (Internal conversion) IC कहते हैं। यह प्रक्रम 10-11 सेकण्ड से भी कम समय में होता है।
अणु ऊर्जा का उत्सर्जन दूसरे प्रक्रम अन्तः तंत्र लंघन (Inter system crossing) ISC द्वारा भी होता – है। इस प्रक्रम में अणु का एक बहुलता अवस्था (singlet multiplicity state) से त्रिक बहुलकता अवस्था अर्थात् अलग बहुलता अवस्था ( different multiplicity) में संक्रमण भी विकिरण रहित (non radiative or radiationless) होते हैं। इसमें भी ऊष्मीय उत्सर्जन होता है लेकिन इनकी गति कम होती है अर्थात् 10- 9 से 10-2 सेकण्ड होते हैं।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics