application of uv spectroscopy in hindi पराबैंगनी स्पेक्ट्रमिकी के अनुप्रयोग लिखिए।
application of uv spectroscopy in hindi पराबैंगनी स्पेक्ट्रमिकी के अनुप्रयोग लिखिए।
पराबैंगनी तथा दृश्य स्पेक्ट्रमिकी के अनुप्रयोग (Application of Ultraviolet and Visible Spectroscopy) परबैंगनी तथा दृश्य स्पेक्ट्रमिकी के अध्ययन का उपयोग विस्तृत है जिनमें से कुछ मुख्य उपयोगों का वर्णन नीचे किया जा रहा है-
1. किसी यौगिक की संरचना का निर्धारण (Assignment of structure of a compound)
यदि दो अलग-अलग पदार्थ समान अवशोषण स्पेक्ट्रम उत्पन्न करते हैं तो यह निश्चित है कि उनकी संरचना भी समान होनी चाहिए क्योंकि एक ही रसायनिक संरचना के पदार्थ एक सा ही अवशोषण स्पेक्ट्रम प्रकट करते हैं। यदि इनमें से एक पदार्थ की संरचना ज्ञात हो तो दूसरे की संरचना का भी निर्धारण किया जा सकता है- जो निम्नलिखित उदाहरण से स्पष्ट है-
(i) नील के ऑक्सीकरण से प्राप्त इसटेन (Instain) की संरचना निम्नलिखित में से एक हो सकती हैं-
1
इसके दो मेथिल व्युत्पन्न हो सकते हैं जिनकी संरचना निम्न प्रकार है-
संरचना III तथा IV के अवशोषण स्पेक्ट्रम से यह पता लगा कि इसटेन का अवशोषण स्पेक्ट्रम इसटेन के N-मेथिल व्युत्पन्न (IV) के समान ही प्राप्त होता है। अतः इसटेन की संरचना II ( लेक्टम संरचना) होनी चाहिए।
(ii) किसी कार्बनिक यौगिक में उपस्थित क्रियात्मक समूह का ज्ञान उस यौगिक के अभिलाक्षणिक अवशोषण बैण्ड (λmax) द्वारा किया जाता है। जैसे λmax का मान यदि 210 mu(nm) के लगभग प्राप्त होता है तो यह इस बात का संकेत है कि यौगिक में – COOH का समूह उपस्थित है।
(iii) यदि अणु दो चलावयवी रूपों (Tautomeric forms) में पाया जाता है तो इसका अध्ययन अवशोषण स्पेक्ट्रा द्वारा किया जा सकता है।
2. किसी यौगिक की पहचान (Identification of a compound)
किसी अज्ञात यौगिक के स्पेक्ट्रम की तुलना ज्ञात यौगिक के अवशोषण स्पेक्ट्रम से करने पर यदि ज्ञात और अज्ञात यौगिकों के स्पेक्ट्रम में अवशोषण बैण्ड लगभग समान तरंग दैयों पर मिलते है तो दोनों की संरचना भी एक सी होगी। यह तकनीक, जिसमें एक अज्ञात यौगिक के स्पेक्ट्रम की, ज्ञात यौगिकों के सोक्ट्रों से तुलना की जाती है, फिंगर प्रिंटिंग (Finger printing) कहलाती है।
3. हाइड्रोजन बन्ध की उपस्थिति ( Presence of hydrogen bonding)
किसी यौगिक के विलयन में हाइड्रोजन बंध की उपस्थिति के कारण से वर्णोंत्कर्षी प्रभाव दिखाई देता है। इस हेतु विलायक का परिवर्तन करने से λmax का मान बदल जाता है अर्थात् हाइड्रोजन बंध पराबैंगनी अवशोषण को कम तरंग दैर्ध्य की तरफ विस्थापित करता है। उदाहरणार्थ- ऐसीटोन का विलयन हैक्सेन में बनाने पर λmax का मान 279 nm होता है जबकि ऐसीटोन का विलयन जल में बनाने पर λmaxका मान 264 एवं एथेनॉल विलायक में 272 nm होता है। अतः दोनों के अवशोषण स्पेक्ट्रा में Amax के मान में अंतर का कारण ऐसीटोन का जल के साथ हाइड्रोजन बंध बनाना है ।
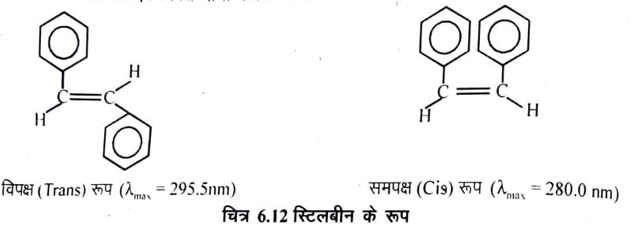
4. समपक्ष-विपक्ष-समावयवता का निर्धारण (Determination of cis-trans isomerism) पराबैंगनी एवं दृश्य स्पेक्ट्रमिकी की सहायता से समपक्ष एवं विपक्ष रूप का निर्धारण किया जा सकता है । संयुग्मित द्विबंध वाले ज्यामितीय समावयवी प्रायः भिन्न-भिन्न अवशोषण बैंड देते हैं। उदाहरणार्थ, स्टिलबीन के समपक्ष एवं विपक्ष दोनों रूप निम्न प्रकार है-
समपक्ष रूप वाली स्टिलबीन के अणु के दोनों फेनिल समूह के हाइड्रोजन परमाणुओं में त्रिविम प्रतिकर्षण (Steric repulsion) होने के कारण दोनों फेनिल समूह एक तल से नहीं रह पाते है। विपक्ष रूप वाले स्टिलबीन में दोनों फेनिल समूह विपरीत दिशा में होने से उनके हाइड्रोजन परमाणुओं में त्रिविम प्रतिकर्षण नहीं होता है और ये समूह एक ही तल में रहते हैं। π इलेक्ट्रॉन भी एक ही तल में होते हैं। इस प्रकार विपक्ष रूप वाले अणु में π-π * संक्रमण सरलता से λmax 295 nm पर हो जाता है जबकि समपक्ष रूप का अवशोषण λmax 280 nm वाली तरंग दैर्ध्य पर होता है। अतः जिस रूप का λmax का मान अधिक होगा वह स्टिलबीन का विपक्ष रूप होगा।
अवरक्त स्पेक्ट्रोस्कोपी (Infrared spectroscopy)
विद्युत चुम्बकीय स्पेक्ट्रम में दृश्य क्षेत्र (visible region) तथा सूक्ष्म तरंग (Micro wave) क्षेत्र के मध्य का क्षेत्र अवरक्त क्षेत्र कहलाता है। अवरक्त क्षेत्र की विकिरणों के तरंगदैर्घ्य का मान दृश्य तथा पराबैंगनी क्षेत्र की विकिरणों के तरंगदैर्ध्य से अधिक परन्तु ऊर्जा का मान कम होता है।
अवरक्त स्पेक्ट्रोस्कोपी का मुख्य आधार किसी अणु के विभिन्न काम्पनिक स्तरों (vibrational levels) के मध्य संक्रमण है । विभिन्न काम्पनिक स्तरों के मध्य संक्रमण के लिए भिन्न-भिन्न ऊर्जा की आवश्यकता होती है। विद्युत चुम्बकीय स्पेक्ट्रम का 0.8 से 200 तक का क्षेत्र अवरक्त क्षेत्र कहलाता है। इस क्षेत्र को अध्ययन की दृष्टि से तीन भागों में विभाजित किया गया है
उदाहरणतः 2.5p तरंगदैर्घ्य का मान 4000 cm 1 होता है।
अवरक्त क्षेत्र में अवशोषण बैण्ड की स्थिति साधारणतः तरंगसंख्या (V) द्वारा प्रदर्शित की जाती है।
आणविक कम्पन (Molecular vibrations)-
प्रत्येक अणु के परमाणु स्थिर अवस्था में नहीं रहते हैं। ये लगातार कम्पन करते रहते हैं। कम्पन्न के कारण परमाणुओं के मध्य बन्ध लम्बाई तथा बन्धकोण में परिवर्तन होता रहता है। किसी अणु के विभिन्न काम्पनिक ऊर्जा स्तर होते हैं। जब किसी अणु द्वारा उचित तरंगदैर्घ्य की विकिरणें अवशोषित की जाती है तो उस अणु में कम्पनीय संक्रमण हो जाता है फलस्वरूप अवरक्त स्पेक्ट्रम में अवशोषण बैण्ड प्राप्त होता है। इलेक्ट्रॉनीय संक्रमण की अपेक्षा कम्पनीय संक्रमण अधिक होता है। यही कारण है कि वि.सी यौगिक के अवरक्त स्पेक्ट्रम में अवशोषण बैण्डों की संख्या, पराबैंगनी स्पेक्ट्रम के अवशोषण बैण्डों की संख्या से अधिक होती है।
कम्पन्नों के प्रकार (Modes of vibrations) – बहुपरमाण्वीय अणुओं में अनेक प्रकार के कम्पन्न होते हैं। n परमाणुओं युक्त अरेखीय अणु में कम्पनों की संख्या (3n-6 ) एवं रेखीय अणुओं में (3n – 5 ) होती है। जैसे-जैसे परमाणुओं की संख्या बढ़ती जाती है कम्पनों की जटिलता उतनी ही अधिक होती जाती है। ऐसे कम्पन जिनकी आवृत्ति समान होती है उन्हें सामान्य अथवा मूलभूत कम्पन (Normal or fundamental vibration) कहते हैं। इन कम्पनों की आवृत्ति मूल आवृति कहलाती है।
क्योंकि सममित तनन कम्पन में द्विध्रुव आघूर्ण के मान में कोई परिवर्तन नहीं होता है । परन्तु यह रमन सक्रिय है तथा इसका एक तीक्ष्ण बैण्ड 1337cm -1 पर प्राप्त होता है।
(ii) असममित तनन कम्पन (Asymmetrical stretching vibrations) – (Vas)
यदि अणु में उपस्थित परमाणुओं का एक साथ तनन एवं सम्पीडन नहीं होता है तो असममित तनन कम्पन होते हैं। अर्थात जब एक गेंद मध्य गेंद के पास जा रही हो तो दूसरी गेंद उसी समय मध्य गेंद से दूर जा रही होती है। (चित्र 1.13)।
CO2 में असममित तनन कम्पन को निम्न प्रकार प्रदर्शित कर सकते हैं जो कि द्विध्रुव आघूर्ण के मान परिवर्तित होने के कारण अवरक्त सक्रिय है।
(2) बंकन कम्पन (Bending vibrations) – इन्हें विरूपण कम्पन (Deformation vibrations) भी कहते हैं। इस प्रकार के कम्पन में समस्त बन्ध दूरियाँ समान रहती है परन्तु परमाणुओं के बन्ध अक्ष के मध्य कोणों में परिवर्तन होता है अथवा पूरे समूह की इस प्रकार से गति होती है कि उस समूह के परमाणुओं की परस्पर सापेक्ष स्थिति तो वही रहती है लेकिन उस समूह की स्थिति शेष अणु के सापेक्ष परिवर्तित हो जाती है। इन कम्पनों को निम्न प्रकार वर्गीकृत किया जा सकता है-
(अ) एक ही तल में (In a plane) –
(i) कर्तरीयण अर्थात् कैंचीनुमा कम्पन (Scissoring vibrations)- ‘8,’ – इस प्रकार के कम्पनों में परमाणु उसी तल में रहते हुए कैंचीनुमा गति करते है अर्थात् इन कम्पनों में एक केन्द्रीय परमाणु जुड़े दोनों परमाणु एक दूसरे की ओर एक साथ पास आते हैं व एक साथ दूसरे से दूर जाते हैं। इस प्रकार के कम्पनों में परस्पर बन्ध कोण परिवर्तित होता रहता है। चित्र 1.14 (अ)।
(ii) संदोली कम्पन (Rocking vibrations) – ‘p’ – इस प्रकार के कम्पनों में अणु के तल में ही समुह का दायीं अथवा बायीं ओर कम्पन होता है। इस प्रकार के कम्पनों में बन्धों के मध्यकोण स्थिर रहते है चित्र 1.14 (ब)।
(ब) तल के बाहर (Out of plane) –
(i) अभिदोलन कम्पन (Wagging vibrations) ‘w’ – इस प्रकार के कम्पनों में कम्पन करने वाला
समूह, अणु के तल के बाहर, ऊपर एवं नीचे कम्पन करता है। इन कम्पनों में बन्ध कोण का मान समान रहता है। चित्र 1.14
(ii) व्यावर्त कम्पन (Twisting vibrations) ‘t’ – यह अभिदोलन कम्पन का असममित प्रकार है। इस प्रकार के कम्पन में अणु के दो भाग एक दूसरे के विपरीत दिशा में जाते हैं। यदि एक परमाणु तल के ऊपर की दिशा में गति करता है तो दूसरा परमाणु तल के नीचे की ओर गति करता है चित्र 1.14 (4) ।
किसी अणु में कितने प्रकार के कम्पन सम्भव है, यह उस अणु की संरचना पर निर्भर करता है। जैसे किसी स्प्रिंग को मोड़ने में खींचने की अपेक्षा कम ऊर्जा की आवश्यकता होती है उसी प्रकार किसी बन्ध को तनित करना, बंकित करने की अपेक्षा ज्यादा कठिन है। यही कारण है कि दोनों प्रकार के कम्पनों में से बंकन कम्पन के लिए कम ऊर्जा की आवश्यकता होती है। अतः बंकन कम्पनों में अणु IR विकिरणों के कम ऊर्जा अर्थात् अधिक तरंगदैर्घ्य अर्थात् कम तरंगसंख्या क्षेत्र में से अवशोषण करते हैं जबकि तनन कम्पन का अवशोषण उस बन्ध की ऊर्जा पर निर्भर करता है। हम जानते हैं कि एकल बन्ध की ऊर्जा द्विबन्ध की ऊर्जा एवं द्विबन्ध की ऊर्जा से त्रिबन्ध की ऊर्जा अधिक होती है। अतः त्रिबन्ध के तनन कम्पन के लिए उच्च ऊर्जा अर्थात् निम्न तरंगदैर्घ्य अर्थात् उच्च तरंगसंख्या पर अवशोषण होना चाहिए एवं होता भी यही है।
द्विध्रुव आघूर्ण एवं अवरक्त स्पेक्ट्रम केवल वे अणु ही मूल कम्पन विकिरणों का अवशोषण करते हैं जिनके अवशोषण के परिणामस्वरूप द्विध्रुव आघूर्ण में परिवर्तन होता है। द्विध्रुव आघूर्ण में यह परिवर्तन परिमाण अथवा दिशा अथवा दोनों में होना चाहिये। यह परिवर्तन तभी सम्भव है जब अणु में पहले से द्विध्रुव आघूर्ण उपस्थित हो। द्विध्रुव आघूर्ण का निर्धारण धनात्मक एवं ऋणात्मक आवेशों के गुरुत्व केन्द्रों की स्थितियों से किया जाता है। कुछ अणु जैसे H2, O2. N2 आदि अवरक्त स्पेक्ट्रम प्रदर्शित नहीं करते क्योंकि इनमें द्विध्रुव आघूर्ण नहीं होता। रैखिक अणु CO2 में सममितीय अवरक्त तनन कम्पन निष्क्रिय है क्योंकि इसके कारण द्विध्रुव आघूर्ण के मान में परिवर्तन नहीं होता ।
←0=C=O →
असममित तनन कम्पन के दौरान अणु के द्विध्रुव आघूर्ण में परिवर्तन हो जाता है। अतः ये अवरक्त सक्रिय कम्पन होते हैं। द्विध्रुव आघूर्ण वाले अणुओं में कम्पनों के दौरान द्विध्रुव आघूर्ण (जो कि एक विद्युत क्षेत्र की तरह व्यवहार करता है) भी लगातार दोलन करता रहता है। विद्युत चुम्बकीय विकिरण जिसमें विद्युत क्षेत्र एवं चुम्बकीय क्षेत्र एक दूसरे के लम्बवत इस प्रकार कम्पन करते है कि कम्पन की आवृत्ति द्विध्रुव आघूर्ण के दोलन की आवृत्ति के बराबर हो जाती है तो अणु विकिरण का अवशोषण करता है।
अवरक्त अवशोषण की तीव्रता इस बात पर निर्भर करती है कि विद्युत चुम्बकीय विकिरण की अवरक्त ऊर्जा कितनी तेजी से अणु में स्थानान्तरित होती है, यह प्रक्रिया बन्ध के द्विध्रुव आघूर्ण पर निर्भर करती है। अधिक ध्रुवीय बन्ध, विद्युत चुम्बकीय विकिरण के साथ अधिक प्रभावी ढंग से अन्योन्य क्रिया करता है जिसके कारण अवरक्त स्पेक्ट्रम में अवशोषण बैण्ड की तीव्रता बढ़ जाती है यही कारण है कि किसी अणु में C= O तनन कम्पन की तीव्रता C-C तनन कम्पन की तीव्रता से अधिक होती है।
हुक का नियम (Hooke’s Low) – किसी बन्ध के तनन कम्पन की आवृति ज्ञात करने के लिए हुक नियम का उपयोग किया जाता है जिसके अनुसार –
यहां u समानीत द्रव्यमान (Reduced mass ) है ।
M1 एवं m2 बन्ध के बन्धित परमाणुओं का द्रव्यमान है।
K = बल नियतांक (Force constant ) जिसके द्वारा किसी बन्ध विशेष की बंध सामर्थ्य (Bond strength) को प्रदर्शित किया जाता है जो एकल बंन्ध के लिए अनुमानतः 5 x 105 g cm -2 है। यह द्विबन्ध तथा त्रिबन्ध के लिए क्रमशः दुगने तथा तिगुने मान के बराबर होता है ।
c = प्रकाश का वेग (Velocity of light) = 3 x 10 10, cm sec-1 कम्पन आवृत्ति का मान मुख्यतः निम्नलिखित कारकों पर निर्भर करता है।
(i) बन्ध सामर्थ्य (Bond strength)
(ii) समानीत द्रव्यमान (Reduced mass)
उपर्युक्त व्यंजक से यह सिद्ध होता है कि यदि बन्ध सामर्थ्य बढ़ायी जाये तथा समानीत द्रव्यमान का मान कम किया जाये तो कम्पन आवृत्ति (Vibrational frequency) का मान बढ़ता है।
C-H तनन कम्पन के लिए कम्पन आवृत्ति ज्ञात करना :- C-H बन्ध तनन कम्पन के लिए कम्पन आवृत्ति का मान निम्नलिखित आंकड़ो की सहायता से ज्ञात किया जा सकता है।
कम्पन आवृति के इस मान को तरंग संख्या (wave number) में परिवर्तित किया जा सकता है।
अवरक्त स्पेक्ट्रोस्कोपी के लिए चयन नियम (Selection rule for IR spectroscopy)-
(1) किसी पदार्थ के द्वारा अवरक्त क्षेत्र की विकिरणों का अवशोषण तभी सम्भव है जब इसके कणों का दोलन करता हुआ द्विध्रुव आघूर्ण अवरक्त क्षेत्र की विकिरणों के दोलन करते हुए विद्युत सदिश (electric vector) के साथ अन्तः क्रिया (intraction) करता है।
इस प्रकार की अन्तः क्रिया तभी सम्भव है जब अणु में कम्पन के एक छोर का द्विध्रुव आघूर्ण (Dipole moment) दूसरे के द्विध्रुव आघूर्ण से पूर्ण रूप से भिन्न हो ।
(2) किसी पदार्थ के द्वारा अवरक्त क्षेत्र की तरंगों का अवशोषण उसमें होने वाले कम्पनों की प्रकृति पर निर्भर करता है। यदि कम्पन केन्द्रीय सममित (centro symmetric) है तो उस पदार्थ द्वारा अवरक्त क्षेत्र की विकिरणों का अवशोषण नहीं किया जायेगा इसके विपरीत यदि कम्पन केन्द्रीय असममित (centro-asymmetric) है तो पदार्थ के द्वारा अवरक्त विकिरणों का अवशोषण किया जायेगा। यही कारण है कि लगभग सभी क्रियात्मक समूह (Functional groups ) अवरक्त क्षेत्र की विकिरणों का अवशोषण करते हैं क्योंकि इनके कम्पन केन्द्रीय सममित (centro symmetric) नहीं होते हैं।
(3) सममित गुण (symmetry properties) एक पदार्थ के अणु के लिये ठोस तथा विलगित निकाय (isolated system) में भिन्न-भिन्न होते हैं।
(4) अवरक्त स्पेक्ट्रोस्कोपी में मुख्य रूप से विभिन्न कम्पन ऊर्जा स्तरों के मध्य संक्रमण होता है। यदि संक्रमण कम्पन के मूल ऊर्जा स्तर (Ground energy state) से प्रथम – उत्तेजित अवस्था में होता है तो प्राप्त बैण्ड मूलभूत बैण्ड (Fundamental band) कहलाता है जो कि तीक्ष्ण बैण्ड होता है। यदि संक्रमण मूल अवस्था से द्वितीय या तृतीय तथा उच्च ऊर्जा स्तरों में होता है तो उससे प्राप्त बैंण्ड ओवरटोन (Overtone) कहलाता है जो कि कम तीक्ष्ण होते हैं। एक बहुपरमाण्विक (Polyatomic) अणु में एक से अधिक मूलभूत बैण्ड पाये जाते हैं तथा इनकी संख्या उस अणु की स्वातन्त्रय की कोटि (Degree of freedom) के बराबर होती है। एक अणु में स्वातंत्रय की काटियों की कुल संख्या 3n बराबर होती है। अर्थात्
यहाँ n = अणु में उपस्थित कुल परमाणुओं की संख्या है एक विलगित निकाय में केवल स्थानान्तरण स्वामन्त्रय की कोटि पायी जाती है। कम्पन्न तथा घूर्णन की स्वतन्त्रता की गति नहीं पायी जाती है। एक अणु सदैव तीन स्थानान्तरण स्वतन्त्रता की कोटि रखता है।
रेखीय अणु के लिए कुल कम्पन की स्वतन्त्रता की कोटि 3n – 3 – 2 = 3n – 5 होती है। क्योंकि इसमें केवल 2 ही घूर्णन की कोटि पायी जाती है।
अरेखीय अणु के लिए कुल कम्पन की स्वतन्त्रता की कोटि = 3n – 3 – 3 = 3n – 6 होती है। इस अध्ययन में केवल हम कम्पन की कोटियों का ही अध्ययन करते हैं यही कारण है कि अवरक्त स्पेक्ट्रोस्कोपी को कम्पनीय स्पेक्ट्रोस्कोपी भी कहते हैं।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics