अवशोषण स्पेक्ट्रम किसे कहते हैं absorption spectra and emission spectra in hindi उत्सर्जन स्पेक्ट्रम
जाने अवशोषण स्पेक्ट्रम किसे कहते हैं absorption spectra and emission spectra in hindi उत्सर्जन स्पेक्ट्रम ?
विद्युत चुम्बकीय स्पेक्ट्रम- अवशोषण स्पेक्ट्रा (Electromagnetic Spectrum : | | Absorption Spectra)
प्रस्तावना (Introduction)
प्रारम्भ में किसी कार्बनिक यौगिक की संरचना ज्ञात करने के लिए अनेक भौतिक एवं रासायनिक विधियाँ जैसे पृष्ठ तनाव, श्यानता, द्विध्रुव आघूर्ण, ध्रुवण घूर्णकता आदि प्रयुक्त की जाती थी परन्तु इनसे यथेष्ठ परिणाम तथा संरचना सम्बन्धी विस्तृत जानकारी नहीं मिलती थी। आजकल कार्बनिक यौगिक की संरचना ज्ञात करने के लिए एक आधुनिक विधि स्पेक्ट्रोस्कोपी (Spectroscopy) की सहायता ली जाती है। रासायनिक यौगिकों की आणविक संरचना ज्ञात करने की यह विधि चुम्बकीय विकिरणों के अवशोषण एवं उत्सर्जन पर आधारित है।
जब श्वेत प्रकाश की किरण को किसी प्रिज्म या ग्रेटिंग में से गुजारा जाता है तो यह विभिन्न रंगों या तरंगदैर्घ्यं के अवयवों में प्रक्षेपित हो जाती है। रंगों के इस प्रक्षेपण को स्पेक्ट्रम कहते हैं।
“किसी अज्ञात संरचना वाले यौगिक का स्पेक्ट्रम प्राप्त करना एवं स्पेक्ट्रम का विश्लेषण कर उस यौगिक की संरचना की व्याख्या करने के विज्ञान को स्पेक्ट्रमिकी (Spectroscopy) कहते हैं। स्पेक्ट्रम के बहुवचन को स्पेक्ट्रा ( Spectra) कहते हैं ।
विद्युत चुम्बकीय विकिरण (Electromagnetic radiations)- प्रकाश, विद्युत चुम्बकीय विकिरणों से मिलकर बना होता है। प्रकाश द्वैत प्रकृति (dual nature) दर्शाता है। सन् 1900 में मैक्स प्लांक ने विकिरणों का क्वान्टम सिद्धान्त प्रतिपादित किया। उसके अनुसार विद्युत चुम्बकीय विकिरणों का अवशोषण अथवा उत्सर्जन सतत् न होकर ऊर्जा पैकट के रूप में होता है जिन्हें क्वांटा या फोटॉन कहते हैं। प्रकाश के तरंगदैर्घ्य (^), आवृत्ति (v) तथा ऊर्जा (E) में निम्नलिखित सम्बंध होता है-
हम जानते हैं
अतः
h प्लांक स्थिरांक है जिसका मान 6.62×10- 34 जूल सैकण्ड तथा c प्रकाश का वेग है जिसका मान 3.0×108 मीटर/सैकण्ड होता है। v (न्यू) दोलन की आवृत्ति है। यह आवर्त की प्रति सैकण्ड संख्या है। ^ (लैम्डा) तरंगदैर्घ्य है। एक आवर्त में तय की गई दूरी को तरंगदैर्घ्य कहते हैं । इसकी लम्बाई A 10-10 मीटर = 10-8 सेमी अथवा nm (नेनोमीटर) या (mu मिली माइक्रोन) = 10-9 मीटर होती है
समीकरण (1) एवं (2) से स्पष्ट है कि जिस विकिरण की ऊर्जा एवं आवृत्ति का मान अधिक होगा उसकी तरंगदैर्घ्य का मान कम होगा अथवा तरंगदैर्घ्य का मान अधिक होने की दशा में विकिरण की ऊर्जा आवृत्ति कम होती है। अतः हम कह सकते हैं कि विकिरण की ऊर्जा उसकी आवृत्ति के समानुपाती तथा तरंगदैर्घ्य के व्युत्क्रमानुपाती होती है।
विद्युत चुम्बकीय विकिरणों के भिन्न-भिन्न भागों के तरंगदैर्घ्य भिन्न-भिन्न होते हैं फलस्वरूप उनकी ऊजाऐं भी भिन्न-भिन्न होती हैं। विद्युत चुम्बकीय विकिरणों के इन्हीं गुणों का उपयोग विभिन्न स्पेक्ट्रोमितीय तकनीकों तथा अन्य कार्यों में किया जाता है।
सारणी 1.1 में विद्युत चुम्बकीय विकिरण के विभिन्न क्षेत्र तथा उनसे सम्बन्धित तरंगदैर्घ्य, ऊर्जा एवं उपयोगों को दर्शाया गया है।
अवशोषण एवं उत्सर्जन स्पेक्ट्रम (Absorption and Emission spectrum)—
जब किसी स्रोत से प्राप्त प्रकाश को अवशोषण करने वाले माध्यम (ठोस, द्रव अथवा गैस) से गुजारा जाता है एवं परिणामी प्रकाश का स्पेक्ट्रोस्कोप की सहायता से विश्लेषण किया जाता है तो उससे प्राप्त स्पेक्ट्रम को अवशोषण स्पेक्ट्रम कहते हैं। ऐसे स्पेक्ट्रम में प्रकाशमान पृष्ठभूमि पर काली अन्धकारमय रेखाऐं अथवा बैण्ड प्राप्त होते हैं। ये काली रेखाऐं यह प्रदर्शित करती हैं कि प्रकाश का यह भाग माध्यम द्वारा अवशोषित किया गया है। जब विकिरण किसी पदार्थ में से होकर गुजरते हैं तो पदार्थ उन तरंगों का वरणात्मक अवशोषण (Selective absorption) कर लेता है जो वह स्वयं तापदीप्त होने पर उत्सर्जित करता है।
जब किसी पदार्थ को तापदीप्त (incandescence) तक गर्म करते हैं अथवा किसी गैस में विद्युत विसर्जन करते हैं तो पदार्थ या गैस विकिरण उत्सर्जित करने लगते हैं। इस विकिरण का यदि स्पेक्ट्रोस्कोप की सहायता से वर्ण विक्षेपण (dispersion) किया जाए तो प्राप्त स्पेक्ट्रम उत्सर्जन स्पेक्ट्रम कहलाता है। उत्सर्जन तथा अवशोषण स्पेक्ट्रम में किसी एक पदार्थ की रेखाओं की स्थिति समान रहती है ।
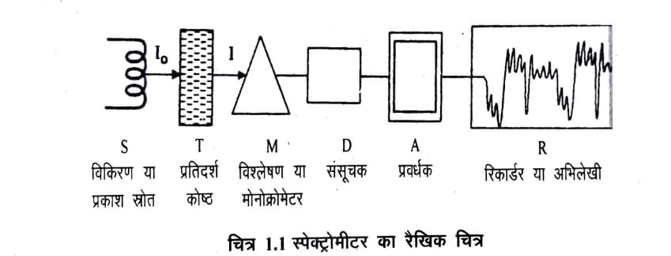
कार्बनिक रसायन विज्ञान में अवशोषण स्पेक्ट्रोस्कोपी का महत्व अधिक है। एक सामान्य अवशोषण स्पेक्ट्रोमीटर एव उसकी कार्यविधि को निम्नलिखित रैखिक चित्र 1.1 के द्वारा सरलता से समझ सकते हैं।
किसी पदार्थ का स्पेक्ट्रम प्राप्त करने के लिए उस पदार्थ को द्रव अथवा विलयन अवस्था में प्रतिदर्श कोष्ठ में भर लेते हैं। प्रतिदर्श कोष्ठ (Sample cell) ऐसे पदार्थ का बना होता है कि वह स्रोत से आने वाले विकिरणों का अवशोषण नहीं करता है। दृश्य स्पेक्ट्रोस्कोपी के लिए यह काँच का, पराबैंगनी के लिए क्वार्ट्ज का तथा अवरक्त विकिरणों के लिए यह क्षार धातुओं के हैलाइड का बना होता है। किसी प्रकाश स्रोत से निश्चित तरंगदैर्ध्य की विकिरण को प्रतिदर्श कोष्ठ में रखे विलयन में से गुजारते हैं। माना प्रकाश की तरंगों की तीव्रता । है । विलयन में से प्रवाहित होने के पश्चात प्रकाश का कुछ भाग पदार्थ एवं विलायक द्वारा अवशोषित कर लिया जाता है इसके बाद शेष प्रकाश की तीव्रता । है । यह प्रकाश मोनोक्रोमेटर में जाता है ।
मोनोक्रोमेटर या विश्लेषक एक घूमने वाली प्रिज्म अथवा ग्रेटिंग होती है जिसके द्वारा विभिन्न तरंगदैर्ध्य वाली विकिरणें पृथक पृथक विभक्त हो जाती है। ये विभिन्न तरंगदैर्घ्य की विकिरणें प्रिज्म के घूर्णन के कारण एक संसूचक पर आपतित होती है। इस प्रक्रम को क्रम वीक्षण (Scanning) कहते हैं।
संसूचक द्वारा प्राप्त विद्युत धारा एवं प्रवर्धक ( amplifier) द्वारा प्रवर्धित होकर रिकार्डर R में पहुँचती हैं जिसमें पदार्थ के अवशोषणांक (abosrbance ) ६ अथवा अवशोषकता (abosrbtivity) log का तरंगदैर्ध्य के विरुद्ध एक आरेख, शीर्ष (Peaks) के रूप में अंकित हो जाता है । यह उस प्रतिदर्श का अवशोषण स्पेक्ट्रम कहलाता है।
विद्युत चुम्बकीय विकिरणों में से प्रकाश के किस विशेष तरंगदैर्घ्य का यौगिक द्वारा किस तीव्रता तक अवशोषण हो, यह यौगिक की संरचना पर निर्भर करता है। अतः अवशोषित प्रकाश की तरंगदैर्ध्य ज्ञात होने पर अज्ञात यौगिक की संरचना ज्ञात की जा सकती है। पदार्थ के द्वारा प्रकाश विकिरणों के अवशोषण के संदर्भ में लैम्बर्ट बीयर नियम (Lambert’s Beer law) का पालन होता है ।
अवशोषण नियम (Absorption Rule)
लैम्बर्ट नियम (Lambert’s law)-
“जब किसी समांगी अवशोषण माध्यम से एकवर्णी प्रकाश, (monochromatic light) का पुंज गुजारा जाता है तो अवशोषक माध्यम की मोटाई (Thickness) के साथ विकिरणों की तीव्रता में हुई कमी आपतित विकिरणों की तीव्रता के समानुपाती होती है।
यहां ऋणात्मक चिन्ह विकिरणों की तीव्रता में हुई कमी को दर्शाता है।
यहाँ । = आपतित विकिरणों की तीव्रता है।
dl = सूक्ष्म मोटाई dx से गुजरने पर विकिरणों की तीव्रता में हुई अनन्त सूक्ष्म कमी है। समाकलन स्थिरांक है जिसे अवशोषण स्थिरांक (Absorption coefficeint) कहते हैं। इसका मान अवशोषक पदार्थ की प्रकृति पर निर्भर करता है ।
जब x = 0.1 = l0 ,x=x.l=I
समी (2) का समाकलन x = 0 तथा x = x की सीमा में करने पर
समीकरण (3) को लैम्बर्ट नियम का गणितीय रूप कहते हैं। जहाँ । आपतित विकिरणों की तीव्रता है तथा । पारगत विकिरणों (transmitted radiations) की तीव्रता है ।
अतः अवशोषक पदार्थ द्वारा अवशोषित विकिरणों की तीव्रता
यहाँ a = अवशोषक माध्यम का विलोपन गुणांक ( extinction coefficient of absorbing medium) है । इसी नियम को 1852 में विलयनों पर लागू कर बीयर (Beer) ने लैम्बर्ट – बीयर नियम (Lambert Beer Law) प्रस्तुत किया इसे बीयर नियम के द्वारा भी जाना जाता है।
बीयर नियम ( Beer’s Law) या लैम्बर्ट बीयर – नियम –
इस नियम के अनुसार “यदि किसी एकवर्णी प्रकाश (monochromatic light) के पुंज को किसी अवशोषक पदार्थ के विलयन में से गुजारा जाये तो अवशोषक विलयन में तय की गयी दूरी के साथ विकिरणों की तीव्रता में हुई कमी आपतित विकिरणों की तीव्रता के साथ-साथ विलयन की सान्द्रता के समानुपाती भी होती है।”
अतः इसे गणितीय रूप में निम्न प्रकार प्रस्तुत किया जा सकता है-
यहाँ K’= समाकलन स्थिरांक है जिसे मोलर अवशोषण (Molar absorption coefficient) कहते हैं। मोलर अवशोषण गुणांक का मान अवशोषक माध्यम की प्रकृति पर निर्भर करता है तथा C= = विलयन की मोलर सांद्रता है ।
अतः समी. (7) का x = 0 एवं x =x की सीमा में समाकलन करने पर
६ को मोलर विलोपन गुणांक (Molar extinction coefficient) या मोलर अवशोषकता (Molar
absorptivity) भी कहते हैं ।
अतः मोलर विलोपन गुणांक या मोलर अवशोषकता एक ग्राम मोल सांद्रता वाले विलयन की एक सेमी. मोटी परत द्वारा उत्पन्न अवशोषणांक के बराबर होता है। स्थिर ताप पर प्रकाश की निश्चित तरंगदैर्घ्य के लिये यह किसी यौगिक का अभिलाक्षणिक गुण है। पराबैंगनी स्पेक्ट्रम में किसी अवशोषण बैंड की तीव्रता अधिकतम अवशोषण पर मोलर अवशोषकता द्वारा प्रदर्शित की जाती है। इसे ६max अथवा द्वारा log६max प्रदर्शित करते हैं। जिस प्रकाश तरंगदैर्घ्य पर यौगिक के अणु अधिकतम ६max दर्शाते हैं, उस तरंगदैर्घ्य को कहते हैं।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics