धातुकर्म का ऊष्मागतिक सिद्धान्त : धातुकर्मीय परिवर्तनों को समझने के लिए मानक गिन्ज
ऊर्जा परिवर्तन (
△G) एक महत्वपूर्ण पद है।
△G को निम्न दो ऊष्मागतिक समीकरणों के आधार पर समझ सकते है।
△G = -RT logK
इस समीकरण के आधार पर
साम्य स्थिरांक (K) का मान धनात्मक होने पर
△G का मान ऋणात्मक होगा , इस स्थिति में धातुकर्मीय परिवर्तन संपन्न होते है।
△G = △H – T△S
इस समीकरण के आधार पर △G का ऋणात्मक मान अभिक्रिया के अग्र दिशा में होने को प्रदर्शित करेगा।
इसके लिए मानक
एंट्रोपी परिवर्तन
△H धनात्मक होना चाहिए तथा
ताप (T) उच्च होने पर समीकरण 2 के आधार पर निम्न स्थिति बनती है।
+△H < –T△S
इस स्थिति में △G का मान ऋणात्मक होगा और धातुकर्मीय परिवर्तन संपन्न होंगे।
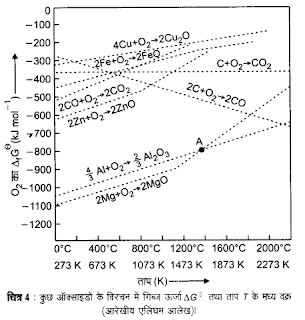
एलिंघम आरेख : HJT एलिघम नामक वैज्ञानिक ने धातु ऑक्साइडो के विरचन को समझाने के लिए
ऑक्सीजन के
△G के मान व ताप (T) के मध्य आरेख दिया जिसे एलिंघम आरेख कहते है , यह आरेख निम्न प्रकार है –
एलिघम आरेख के गुण व निष्कर्ष
1. धातु ऑक्साइडो के विघटन की अभिक्रिया निम्न प्रकार है –
2M + O2 → 2MO
इस क्रिया में ऑक्सीजन गैस का उपभोग होता है अर्थात गैसीय
पदार्थ की मात्रा घटती है अत: एंट्रोपी घटती है तथा एंट्रोपी परिवर्तन (
△S) का मान ऋणात्मक आता है इसलिए
△G का मान बढ़ता है अत: गिब्स ऊर्जा परिवर्तन के समीकरण के आधार पर T का मान बढ़ाने पर
△G के मान में वृद्धि होती है इसलिए एलिंघम आरेख में लगभग सभी वक्रो का ढाल ऊपर की ओर होता है।
2. प्रावस्था परिवर्तन वाले वक्रो को छोड़कर लगभग सभी वक्र सीधी रेखा में प्राप्त होते है।
3. एलिघम आरेख में T का मान बहुत अधिक बढाने पर ताप (T) के जिस जिस मान पर
△G का मान धनात्मक हो जाता है उस ताप पर धातु ऑक्साइड स्वयं
धातु में परिवर्तित हो जाता है।
4. यदि किसी निकाय में दो अभिक्रियाएँ एक साथ संपन्न हो रही हो तो यदि कुल अभिक्रिया के लिए परिणामी △G का मान ऋणात्मक आता है तो वह अभिक्रिया संपन्न होती है।
एलिंघम आरेख से धातु के ऑक्साइड के ऊष्मीय अपचयन की संभावना
1. एलिघम आरेख से धातु ऑक्साइड के
अपचयन के लिए उचित ताप का पता चलता है।
2. इस आरेख से धातु ऑक्साइड के अपचयन के लिए उचित अपचायक का भी ज्ञान होता है जैसे – एलिघम आरेख में उपस्थित दो वक्रो में से नीचे वाले वक्र में उपस्थित धातु , ऊपर वाले वक्र में उपस्थित धातु ऑक्साइड को अपचयित कर सकती है।
3. यदि दो वक्रो एक दुसरे को प्रतिच्छेदित करते है तो प्रतिच्छेदन बिंदु पर उपस्थित ताप से कम ताप पर नीचे वाली धातु ऊपर स्थित धातु ऑक्साइड को अपचयित कर देती है तथा प्रतिच्छेदन बिंदु पर उपस्थित ताप से अधिक ताप पर ऊपर वाली धातु नीचे स्थित ऑक्साइड को अपचयित कर देती है।
4. यदि धातु ऑक्साइड के अपचयन के ताप पर निर्मित धातु द्रव अवस्था में हो तो धातु ऑक्साइड का अपचयन आसानी से होता है क्योंकि ठोस से द्रव अवस्था में बदलने पर एंट्रोपी बढ़ने से
△S का मान धनात्मक आता है अत: मानक
गिब्स ऊर्जा परिवर्तन की समीकरण (
△G = △H – T△S) के आधार पर
△S धनात्मक होने से
△G का मान ऋणात्मक आता है इसलिए धातु ऑक्साइड का आसानी से अपचयन हो जाता है।
एलिंघम आरेख की कमियां
1. एलिंघम आरेख से धातु ऑक्साइड के अपचयन के लिए उचित ताप का पता चलता है लेकिन यह अपचयन अभिक्रिया के
वेग को नहीं बताता है। अर्थात यह आरेख धातु ऑक्साइडो के अपचयन की केवल ऊष्मागतिक व्याख्या करता है।
रासायनिक बलगतिकी की व्याख्या नहीं करता है।
2. इस आरेख में
△G के मान साम्य स्थिरांक K के आधार पर दिए गए है। यदि अभिकारक व उत्पाद
ठोस अवस्था में हो तो इनकी
सांद्रता इकाई मानी जाती है अत: इस स्थिति में K के आधार पर
△G के मान सही प्राप्त नहीं होते है।
प्रश्न 1 : एलिघम आरेख के आधार पर हेमेटाइड (Fe2O3) का C व CO द्वारा अपचयन किस ताप पर होता है ? बताइये।
उत्तर : इस आरेख से स्पष्ट है कि प्रतिच्छेदन बिंदु पर उपस्थित ताप 1073K ताप है।
1073K ताप से कम ताप पर CO , Fe2O3 को Fe में अपचयित कर देता है।
Fe2O3 + 3CO → 2Fe + 3CO2
1073K से अधिक ताप पर C , Fe2O3 को Fe में अपचयित कर देता है।
Fe2O3 + 3C → 2Fe + 3CO