विलेयता गुणनफल क्या है परिभाषा उदाहरण किसे कहते हैं (solubility product in hindi) , विलेयता (S) व विलेयता गुणनफल (KS.P) में सम्बन्ध
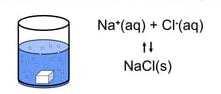
(solubility product in hindi) विलेयता गुणनफल क्या है परिभाषा उदाहरण किसे कहते हैं : निश्चित ताप पर किसी अल्प विलय विद्युत अपघट्य के संतृप्त विलयन में आयनों के गुणनफल को विलेयता गुणनफल कहते है।
AgCl ⇌ Ag+ + Cl–
1 0 0
माना AgCl की विलेयता S मोल/लीटर है।
1 – s s s
K = [Ag+][Cl–]/[AgCl]
AgCl संतृप्त विलयन है अत:
K x [AgCl] = [Ag+][Cl–]
KS.P = [Ag+][Cl–]
KS.P = S x S
KS.P = S2
S = √ KS.P
नोट : विलेयता गुणनफल > आयनिक गुणनफल : असंतृप्त विलयन
विलेयता गुणनफल = आयनिक गुणनफल : संतृप्त विलयन
विलेयता गुणनफल = आयनिक गुणनफल : असंतृप्त विलयन : इस दशा में अवक्षेप बनता है।
विलेयता : विलय की वह अधिकतम मात्रा जो 1 लीटर विलयन में निश्चित ताप पर घुली हुई अवस्था में होती है , उसकी विलेयता कहलाती है।
संतृप्त विलयन : संतृप्त विलयन उस विलयन को कहते है जिसमें लवण (विलेय) की सूक्ष्म मात्रा को भी घोलना संभव नहीं होता है।
निम्न लवणों की विलेयता (S) व विलेयता गुणनफल (KS.P) में सम्बन्ध :
(i) एक एक संयोजी विद्युत अपघट्य :
AgCl ⇌ Ag+ + Cl–
KS.P = [Ag+][Cl–]
KS.P = S x S
KS.P = S2
S = √ KS.P
(ii) द्वि द्वि संयोजी विद्युत अपघट्य :
BaSO4 ⇌ Ba2+ + SO42-
S S
KS.P = [Ba2+][SO42-]
KS.P = S x S
S = √ KS.P
(iii ) एक द्वी संयोजी विद्युत अपघट्य :
A2B ⇌ 2A+ + B2-
2S S
KS.P = [A+]2 [B2-]
KS.P = (2s)2 (s)
KS.P = 4s3
S =

(iv ) एक त्रि संयोजी विद्युत अपघट्य :
A3B ⇌ 3A+ + B3-
3S S
KS.P = [A+]3 [B3-]
KS.P = (3s)3 (s)
KS.P = 27s3 x s
KS.P = 27s4
S =

(v) द्वि त्रि संयोजी विद्युत अपघट्य :
A3B2 ⇌ 3A2+ + 2B3-
3s 2s
KS.P = [A2+]3 [B3-]2
KS.P = (3s)3 (2s)2
KS.P = 27s3 x 4s2
KS.P = 108 s5
S =

विलेयता गुणनफल के अनुप्रयोग
- गुणात्मक विश्लेषण में:
प्रश्न 1 : IInd समूह की धातुओं को अवक्षेपित करने के लिए अम्लीय माध्यम में H2S गैस प्रवाहित की जाती है , क्यों ?
उत्तर : IInd समूह की धातुओं के सल्फाइड का विलेयता गुणनफल कम होता है , इन्हें अवक्षेपित करने के लिए कम सल्फाइड आयनों की आवश्यकता होती है अत: अम्लीय माध्यम में H2S गैस प्रवाहित की जाती है।
H2S ⇌ 2H+ + S2-
HCl ⇌ H+ + Cl–
सम आयन प्रभाव के कारण H2S का आयनन कम होता है जिससे कम सल्फाइड आयन प्राप्त होते है , सल्फाइड आयनों की यह कम मात्रा IInd समूह की धातुओं को अवक्षेपित करने के लिए पर्याप्त होती है।
प्रश्न 2 : IVth समूह की धातुओं को अवक्षेपित करने के लिए क्षारीय माध्यम में H2S गैस क्यूँ प्रवाहित की जाती है ?
उत्तर : IVth समूह की धातुओं के सल्फाइड का विलेयता गुणनफल अधिक होता है , इन्हें अवक्षेपित करने के लिए अधिक सल्फाइड आयनों की आवश्यकता होती है अत: क्षारीय माध्यम में H2S गैस प्रवाहित की जाती है।
2NH4OH ⇌ 2NH4+ + 2OH–
H2S ⇌ S2- + 2H+
उपरोक्त क्रिया में OH– , H+ से क्रिया कर लेते है जिससे H+ की भरपाई करने के लिए H2S का आयनन अधिक होता है।
प्रश्न 3 : III rd समूह की धातुओं को अवक्षेपित करने के लिए NH4OH मिलाने से पूर्व NH4Cl क्यों मिलाया जाता है।
उत्तर : IIIrd समूह की धातुओं के OH– का विलेयता गुणनफल कम होता है , इन्हें अवक्षेपित करने के लिए कम OH– की आवश्यकता होती है अत: NH4OH मिलाने से पूर्व NH4Cl मिलाया जाता है।
NH4OH ⇌ NH4+ + OH–
NH4Cl ⇌ NH4+ + Cl–
सम आयन प्रभाव के कारण NH4OH का आयनन कम हो जाता है जिससे कम OH– प्राप्त होते है , OH– की यह कम मात्रा III rd समूह की धातुओं को अवक्षेपित करने के लिए पर्याप्त होती है।
प्रश्न 4 : III rd समूह में NH4Cl व NH4OH मिलाने से पूर्व सान्द्र HNO3 की एक दो बूंद क्यों मिलायी जाती है ?
उत्तर : Fe2+ (फेरस) को Fe3+ (फेरिक) में परिवर्तित करने के लिए सान्द्र HNO3 की एक दो बूंद मिलायी जाती है।
Fe(OH)2 (फेरस हाइड्रोक्साइड) का विलेयता गुणनफल अधिक होता है। इन्हें अवक्षेपित करने के लिए अधिक OH– की आवश्यकता होती है जबकि फेरिक हाइड्रोक्साइड [Fe(OH)3] का विलेयता गुणनफल कम होता है , इन्हें अवक्षेपित करने के लिए कम OH– की आवश्यकता होती है।
प्रश्न 5 : Vth समूह का परिक्षण Ba2+ , Sr2+ व Ca2+ इसी क्रम में किया जाता है क्यों ?
उत्तर : Ba2+ , Sr2+ व Ca2+ से युक्त विलयन में पोटेशियम क्रोमेट (K2CrO4) डालने पर बेरियम क्रोमेट का अवक्षेप बनता है क्यूंकि इसका आयनिक गुणनफल इसके विलेयता गुणनफल से अधिक होता है।
[Ba2+][CrO42-] > Ks.P
जबकि Sr2+ व Ca2+ अवक्षेपित नहीं होते है।
अमोनियम सल्फेट [(NH4)2SO4] डालने पर Ba2+ व Sr2+ तो अवक्षेपित हो जाते है परन्तु Ca2+ अवक्षेपित नहीं होता है क्यूंकि –
[Ba2+][SO42-] > Ks.P
[Sr2+][SO42-] > Ks.P
अमोनिया ऑक्सलेट [(NH4)2C2O4] डालने पर Ba2+ , Sr2+ व Ca2+ तीनो ही अवक्षेपित हो जाते है क्योंकि
[Ba2+][C2O42-] > Ks.P
[Sr2+][C2O42-] > Ks.P
[Ca2+][C2O42-] > Ks.P
अत: Ca2+ का परिक्षण करने से पूर्व Ba2+ को पोटेशियम क्रोमेट द्वारा तथा Sr2+ को अमोनियम सल्फेट द्वारा अवक्षेपित कर हटा देना चाहिए।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics