नाइट्राइल से ऐल्डिहाइड एवं कीटोन का संश्लेशण , नाइट्राइल से कीटोन का संश्लेषण समझाइये
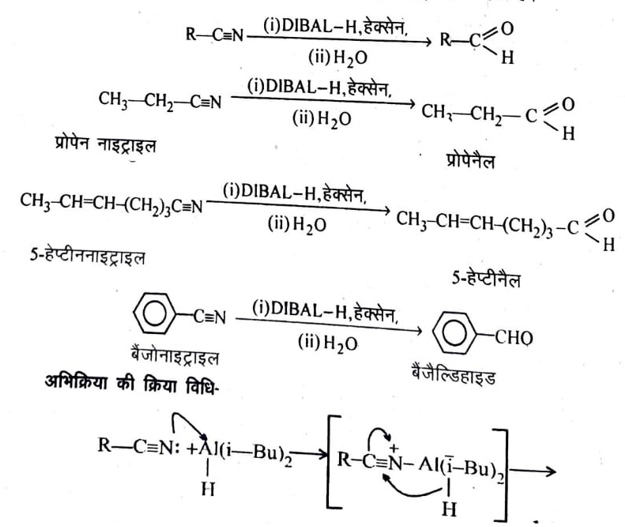
नाइट्राइल से कीटोन का संश्लेषण समझाइये ?
नाइट्राइल से ऐल्डिहाइड एवं कीटोन का संश्लेशण
(A) नाइट्राइल से ऐल्डिहाइड का संश्लेषण ऐल्डिहाइड का नाइट्राइल से संश्लेषण निम्नलिखित दो प्रकार से किया जा सकता है-
(1) ऐल्केन नाइट्राइल (सायनों ऐल्केन) के अपचयन से स्टीफेन विधि (Stephen’s method)- ऐल्केन नाइट्राइल स्टेनस क्लोराइड और हाइड्रोक्लोरिक अम्ल द्वारा अपचयन पर ऐल्डिमीन बनाते है जो जल अपघटन करने पर ऐल्केनैल देते हैं। यह विधि स्टीफेन अभिक्रिया कहलाती है।
(2) नाइट्राइल का डाइआइसोब्यूटिल ऐलुमिनियम हाइड्राइड (DIBAL-H) के द्वारा अपचयन- ऐलिफेटिक एवं ऐरोमेटिक दोनों प्रकार नाइट्राइल का डाइआइसोब्यूटिल ऐलुमिनियम हाइड्राइड के द्वारा हेक्सेन विलायक में निम्न ताप पर अपचयन से ऐल्डिहाइड प्राप्त होते हैं।
(B) नाइट्राइल से कीटोन का संश्लेषण
(1) नाइट्राइल से कीटोन का संश्लेषण- नाइट्राइल (R-C=N) की ग्रीन्यार अभिकर्मक या आर्गेनोलीथियम अभिकर्मक के साथ अभिक्रिया से प्राप्त उत्पाद का जल अपघटन करके किया जा सकता है।
(i) ग्रीन्यार अभिकर्मक से अभिक्रिया- ऐल्किल या ऐरिल मैग्नीशियम हैलाइड की नाइट्राइल से अभिक्रिया पर प्राप्त उत्पाद का जल अपघटन करने पर कीटोन प्राप्त होता है।
(ii) ऑर्गेनो लीथियम यौगिकों से अभिक्रिया- नाइट्राइल (R-C=N या ArC=N) आर्गनों लीथियम यौगिकों (R-Li) से शुष्क ईथर में ग्रीन्यार अभिकर्मक की भांति ही अभिक्रिया कर लेते हैं। अभिक्रिया के फलस्वरूप बने उत्पाद का जल अपघटन करने पर कीटोन प्राप्त होते हैं।
कार्बोक्सिलिक अम्लों से ऐल्डिहाइड एवं कीटोन का संशलेषण
(A) कार्बोक्सिलिक अम्लों से ऐल्डिहाइड का संश्लेषण
(1) कार्बोक्सिलिक अम्लों के कैल्सियम लवणों के शुष्क आसवन से (i) कैल्सियम मेथेनोएट (कैल्सियम फॉर्मेट) के शुष्क आसवन से मेथेनैल बनाता है-
(ii) कैल्सियम मेथेनोएट और अन्य कार्बोक्सिलिक अम्लों के कैल्सियम लवण के मिश्रण के शुष्क आसवन से ऐल्डिहाइड प्राप्त होते हैं।
(2) ऐल्केनोइक अम्ल के उत्प्रेरित विघटन से- मेथेनोइक अम्ल वाष्प को ऐल्कोनोइक अम्ल वाष्प के साथ मिश्रित करके 573 K ताप पर तप्त MnO पर प्रवाहित करने पर ऐल्केनैल बनते हैं। केवल मेथेनोइक अम्ल की वाष्प को प्रवाहित करने पर मेथेनैल बनता
(B) कार्बोक्सिलिक अम्लों से कीटोन का संश्लेषण-
(1) कार्बोक्सिलिक अम्लों के कैल्सियम लवणों के शुष्क आसवन से- कैल्सियम मेथेनोऐट के अतिरिक्त अन्य कैल्सियम लवणों का शुष्क आसवन करने पर कीटोन प्राप्त होते हैं।
(2) ऐल्केनोइक अम्लों के उत्प्रेरित विघटन से- मेथेनोइक अम्ल के अतिरिक्त अन्य ऐल्केनोइक अम्ल वाष्प को 300° ताप पर तप्त MnO पर से प्रवाहित करने पर ऐल्केनोन बनते हैं ।
(3) ऐल्केनोइक अम्ल की ऐल्किल लीथियम (RLi) के साथ अभिक्रिया से ऐल्केनाइक अम्ल के दो अणुओं की ऐल्किल लीथियम के साथ अभिक्रिया से प्राप्त उत्पाद का जल अपघटन करने पर ऐल्केनॉन बनते हैं।
ऑक्सीकरण से
(1) ऐल्कोहॉल से (From alcohol):- ऐल्कोहॉलों के ऑक्सीकरण द्वारा ऐल्डिटाइड तथा कीटोन का निर्माण होता है। प्राथमिक ऐल्कोहलों के ऑक्सीकरण पर ऐल्डिहाइड तथा द्वितीयक ऐल्कोहलों के ऑक्सीकरण पर कीटोन प्राप्त होते हैं।
ऑक्सीकारक में रूप में अम्लीय K2 Cr2 O7 अथवा क्षारीय KMnO4काम में लेते हैं। इन अभिक्रियाओंमें बने ऐल्डिहाइड तथा कीटोन पुनः ऑक्सीकृत होकर अम्ल देते हैं।
(2) ओपेनॉअर ऑक्सीकरण :- यदि ऐल्कोहलों का ऑक्सीकरण तृतीयक ब्यूटिल क्रोमेट द्वारा किया जाता है तो यह अम्ल में ऑक्सीकृत नहीं होता है। ऐलुमीनियम तृतीयक ब्यूटॉक्साइड द्वितीय ऐल्कोहॉल को कीटोन में परिवर्तित करता हैं।
यदि ऐसीटोन के स्थान पर p-बैजोक्विनोन काम में ले तो प्राथमिक ऐल्कोहलों को ऐल्डिहाइड में परिवर्तित किया जा सकता है। यदि ऐल्कोहॉल में असंतृप्तता हो तो इस अभिकर्मक की उपस्थिति में केवल – OH समूह का ऑक्सीकरण होता है। द्विबन्ध अथवा त्रिबन्ध इससे प्रभावित नहीं होता है।
भौतिक गुण (Physical Properties)
(1) भौतिक अवस्था (Physical state) – साधारण तापक्रम पर मेथेनैल गैस है। अणुसूत्र C11H22O तक के ऐल्केनैल द्रव और इसके आगे के ठोस हैं।
(2) गन्ध (Odour)- निम्नतर ऐल्केनैल की गन्ध अरूचिकर होती है परन्तु उच्चतर सदस्यों की फलों जैसी गन्ध (Fruity smell) होती है। C8 – C13 तक के ऐल्केनैल सुगन्ध (Perfumes) के रूप में प्रयोग किये जाते हैं।
ऐल्केनोन रूचिकर गन्ध वाले द्रव होते हैं। CIT 1 तक के ऐल्केनोन भी सुगन्ध के रूप में प्रयुक्त होते हैं।
(3) घुलनशीलता (Solubility)- निम्नतर ऐल्केनैल तथा ऐल्केनोन दोनों ही जल में घुलनशील हैं परन्तु अणुभार बढ़ने के साथ जल में इनकी घुलनशीलता कम होती जाती है। C5 या इससे अधिक कार्बन वाले यौगिक जल में अल्पविलेय या अविलेय होते हैं। निम्नतर कार्बोनिल यौगिकों की जल में घुलनशीलता का कारण ध्रुवीय कार्बोनिल समूह और द्विध्रुव जल के मध्य स्थिर वैद्युत आकर्षण (electrostatic attraction) का होना है।
ये कार्बनिक विलायकों जैसे ऐल्कोहॉल और ईथर आदि में भी पूर्ण रूप से विलेय होते हैं।
(4) क्वथनांक (Boiling point )—- ऐल्केनैल तथा ऐल्केनोन में कार्बोनिल समूह में ध्रुवणता होने के कारण ये ध्रुवीय होते हैं। कार्बोनिल समूह की इस ध्रुवणता के कारण इनमें अन्तराअणुक संगणन (Intermolecular association) हो जाता है और फलस्वरूप समान अणुभार वाले ऐल्केन की तुलना में इनके क्वथनांक उच्च होते हैं परन्तु यह अन्तराअणुक संगुणन ऐल्केनॉन की अपेक्षा ऐल्केनैल और ऐल्केनोन में कम होता है जिससे इनके क्वथनांक लगभग समान अणुभार वाले ऐल्केनॉल की अपेक्षा कम होते हैं।
कार्बोनिल समूह (>C=0) की संरचना (Structure of Carbonyl Group)
जैसा कि ऊपर बताया जा चुका है ऐल्केनोन में कार्बोनिल समूह (>C=O) उपस्थित होता है। इस >C = O समूह को ऐल्कीन के > C = C< समूह के समान ही माना जा सकता है। इसमें भी कार्बन तथा ऑक्सीजन परमाणु दोनों ही sp2 संकरित अवस्था में होते हैं।
इस प्रकार कार्बन और ऑक्सीजन दोनों परमाणुओं पर ही तीन-तीन sp 2 संकरित कक्षक होते है जो एक-दूसरे से 120° के कोण पर अभिविन्यासित होते हैं तथा एक p, कक्षक बचा रहता है। कार्बन परमाणु के तीनों sp2 संकरित कक्षक तीन सिग्मा बन्ध बनाने में प्रयुक्त होते हैं जिनमें से एक ऑक्सीजन परमाणु के sp2 संकरित कक्षक से 0 बंध बनाता है। कार्बन तथा ऑक्सीजन परमाणु पर उपस्थित Pz. कक्षक पार्श्व अतिव्यापन द्वारा -बंध बनाते हैं। अतः कार्बन तथा ऑक्सीजन परमाणु के मध्य एक सिग्मा तथा एक पाई बन्ध उपस्थित होता है। यहाँ यह ध्यान देने योग्य बात है कि कार्बन के तीनों sp – संकरित कक्षक तो तीन सिग्मा बंध बनाने में प्रयुक्त हो जाते हैं परन्तु ऑक्सीजन के तीन में से केवल एक ही sp संकरित कक्षक एक सिग्मा बंध बनाने में काम आता है और शेष दोनों में एकाकी इलेक्ट्रॉन युग्म (अबन्धित इलेक्ट्रॉन युग्म) उपस्थित होते हैं (चित्र 5.1 )
ऐल्डिहाइड एवं कीटोन में कार्बन – ऑक्सीजन द्विबंध की औसत लम्बाई 122pm होती है। कार्बोनिल को ‘प्रयुक्त करने वाले यौगिकों में बंध कोण 120° के निकट होते हैं।
फार्मेल्डिहाइड, ऐसीटैल्डिहाइड एवं एसीटोन अणुओं की संरचना एवं बंध कोण निम्न प्रकार प्रदर्शित कर सकते हैं।
कार्बोनिल समूह की ध्रुवणता एवं क्रियाशीलता (Polarity and reactivity of carbonyl group)— कार्बोनिल समूह >C=0 में ऑक्सीजन परमाणु की विद्युतऋणता (3.5), कार्बन परमाणु (2.5) की अपेक्षा बहुत अधिक है। अतः -बंध के इलेक्ट्रॉन (7-इलेक्ट्रॉन घनत्व) ऑक्सीजन की तरफ विस्थापित हो जाते हैं। इससे कार्बन ऑक्सीजन बंध का ध्रुवण हो जाता है और कार्बन पर आंशिक धनावेश तथा ऑक्सीजन पर आंशिक ऋणावेश आ जाता है। कार्बोनिल समूह को निम्नलिखित दो संरचाओं का अनुनादी संकर भी माना जा सकता है।
ऐल्डिहाइड एवं कीटोन का द्विध्रुव आघूर्ण (i) संगत ऐल्कीन की अपेक्षा काफी अधिक होता है। उदाहरणार्थ-
कार्बोनिल समूह पर ऐल्किल समूह की उपस्थिति इसके स्थायित्व को उसी प्रकार बढ़ा देती है जिस से कार्बन – कार्बन द्विबंध और कार्बोधनायन के स्थायित्व को sp2 कार्बन को इलेक्ट्रॉन मोचन (Electron releasing) करके बढ़ा देती है। 2- ब्यूटेनॉन का स्थायित्व इसके समावयवी ब्यूटेनैल के स्थायित्व से ज्यादा है क्योंकि 2 – ब्यूटेनॉन के दहन की ऊष्मा अपेक्षाकृत कम है।
कार्बोनिल समूह के कार्बन परमाणु पर इलेक्ट्रॉन घनत्व कम हो जाने के कारण कार्बोनिल समूह का यह कार्बन परमाणु इलेक्ट्रॉन को अपनी ओर आकर्षित करता है इस कारण कार्बोनिल यौगिक निम्नलिखित दो प्रकार की अभिक्रियायें प्रदर्शित करते हैं-
(i) कार्बोनिल समूह के कार्बन पर नाभिकस्नेही अभिकर्मकों का योग
(ii) कार्बोनिल समूह के कार्बन पर इलेक्ट्रॉन घनत्व की कमी से – हाइड्रोजन परमाणु की अम्लीय प्रकृति के कारण क्षार की उपस्थिति में ऋणायन का निर्माण ।
कार्बोनिल समूह की क्रियाशीलता को प्रभावित करने वाले कारक-
कार्बोनिल समूह के कार्बन परमाणु पर उपस्थित अन्य समूह, इसकी क्रियाशीलता पर बहुत प्रभाव डालते हैं।
(i) ऐसे परमाणु या समूह जो कार्बन परमाणु पर उपस्थित धनावेश को इलेक्ट्रॉन प्रदान करके (+I प्रभाव द्वारा) कम कर देते हैं, कार्बोनिल यौगिकों की क्रियाशीलता को कम कर देते हैं।
कार्बोनिल समूह के कार्बन परमाणु पर जुड़ने वाले ऐल्किल समूह में जैसे-जैसे कार्बन परमाणुओं की संख्या बढ़ती जाती है तो कार्बोनिल यौगिक की क्रियाशीलता कम होती जाती है। जैसे-
इसी प्रकार यदि कार्बोनिल समूह के कार्बन पर बेन्जीन वलय उपस्थित हो तो इलेक्ट्रॉन के अस्थानीकरण (delocalization) से कार्बोनिल समूह की क्रियाशीलता कम हो जाती है ।
बेन्जेल्डिहाइड, ऐसीटोफीनोन व बेन्जोफीनोन की क्रियाशीलता निम्न प्रकार से घटते हुए क्रम में होती है।
स्थूल समूह (Bulky groups ) भी कार्बोनिल समूह की क्रियाशीलता को कम करते हैं।
(ii) ऐसे परमाणु या समूह जो a-कार्बन पर उपस्थित हो तथा अपनी ओर इलेक्ट्रॉन को आकर्षित करते हों तो कार्बोनिल समूह के कार्बन परमाणु पर इलेक्ट्रॉन घनत्व को और कम कर देते हैं अर्थात धनादेश में वृद्धि कर देते हैं, अतः कार्बोनिल समूह की क्रियाशीलता बढ़ाते हैं। जैसे- ट्राई क्लोरो ऐसीटैल्डिहाइड, हैक्साफ्लुओरो ऐसीटोन इत्यादि में कार्बोनिल समूह की क्रियाशीलता अधिक होती है।
`बेन्जीन वलय में आर्थो या पेरा स्थितियों पर इलेक्ट्रॉन आकर्षी समूह जैसे – – NO 2, -CN इत्यादि उपस्थित हो तो ” इलेक्ट्रॉनों के अस्थानीकरण से कार्बोनिल समूह की क्रियाशीलता बढ़ जाती है। ऐल्डिहाइड व कीटोन ध्रुवीय (polar) प्रकृति के होते हैं । अतः इन यौगिकों का क्वथनांक समान अणुभार रखने वाले अध्रुवीय (Nonpolar) यौगिकों से अधिक होता है। किन्तु इन यौगिकों में हाइड्रोजन बंध नहीं पाया जाता है अतः समान अणु भार वाले ऐल्कोहॉल की तुलना में इन यौगिकों का क्वथनांक कम होता है।
कार्बोनिल यौगिकों की कुछ नाभिकस्नेही अभिक्रियाओं के उदाहरण निम्नलिखित है ।
(i) हाइड्रोजन सायनाइड का योग (Addition of HCN):- हाइड्रोजन सायनाइड के योग पर कार्बोनिल यौगिक सायनोहाइड्रिन बनाते है जो जल अपघटन पर हाइड्रॉक्सी अम्ल बनाते हैं ।
(ii) सोडियम हाइड्रोजन सल्फाइड का योग (Addition of sodium hydrogen sulphite):- कार्बोनिल यौगिक सोडियम हाइड्रोजन सल्फाइड के साथ अभिक्रिया पर योगोत्पाद (Adduct) देता है।
कार्बनिक समूह पर SO32- सल्फर परमाणु के द्वारा जुड़ता है, ऑक्सीजन परमाणु द्वारा नहीं क्योंकि सल्फर की नाभिकस्नेहता अधिक होता है तथा यह मृदु क्षार होता है।
(iii) जल योग (Addition of water ) :- कार्बोनिल यौगिक तनु अम्लीय अथवा क्षारीय माध्यम में जल के साथ योग पर जेम डाइऑल बनाते हैं। ये अस्थायी होते हैं अतः इन्हें प्राप्त नहीं किया जा सकता है परन्तु यदि कार्बोनिल समूह पर कोई इलेक्ट्रॉन आकर्षित करने वाला प्रतिस्थापी समूह जुड़ा हो तो स्थायी हाइड्रेट प्राप्त होते हैं।
(iv) ऐल्कोहॉल का योग :- ऐल्डिहाइड, ऐल्कोहॉल के साथ योग पर पहले हैमीऐसीटैल फिर ऐसीटैल बनाते है जबकि कीटोन से हैमीकीटैल तथा कीटैल प्राप्त होते हैं।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics