प्रभाजी आसवन सिद्धांत विधि का सचित्र वर्णन कीजिए Theory of Fractional Distillation in hindi
Theory of Fractional Distillation in hindi प्रभाजी आसवन सिद्धांत विधि का सचित्र वर्णन कीजिए ?
प्रभाजी आसवन सिद्धान्त (Theory of Fractional Distillation)
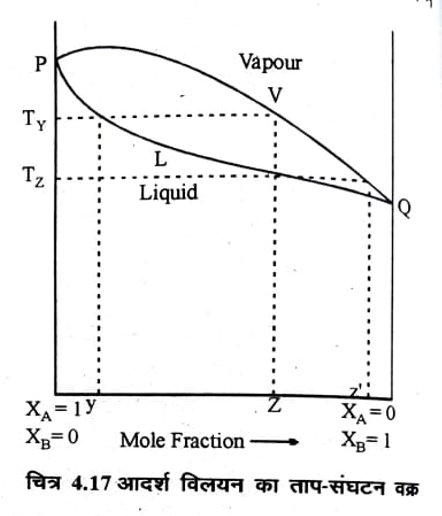
होंगे अतः इन विलयनों के क्वथनांक (boiling point) भी भिन्न-भिन्न होंगे। विलयन का वाष्प दाब कम राऊल के नियम से यह स्पष्ट है भिन्न-भिन्न सान्द्रताओं के विलयनों के वाष्प दाब भिन्न-भिन्न होने पर उसका क्वथनांक उच्च तथा विलयन का वाष्प दाब अधिक होने पर उसका क्वथनांक निम्न होगा । यहाँ यह स्पष्ट करना आवश्यक है कि यह ताप जिस पर विलयन का वाष्प दाब बाह्य दाब के बराबर हो जाता है, उस विलयन का क्वथनांक कहलाता है। जिस विलयन का वाष्पदाब कम होगा, उसको बाह्यदाब के बराबर करने के लिये उच्च ताप तक गर्म करना होगा, अतः क्वथनांक अधिक होगा। इसी प्रकार अधिक वाष्प दाब के विलयन को निम्न ताप तक गर्म करके ही उसके वाष्प दाब को बाह्य दाब के बराबर किया जा सकता है अतः क्वथनांक कम होगा। इसी आधार पर विलयन का क्वथनांक- संघटन वक्र ज्ञात किया जा सकता है, जिसे ताप-संघटन वक्र भी कहते हैं ताप संघटन से द्रव विलयन को प्रभाजी आसवन के सिद्धान्त को समझाया गया है।
चित्र 4.17 में एक आदर्श विलयन का ताप-संघटन वक्र दर्शाया गया है।
चित्र 4.17 में PVQ क्वथनांक – वाष्प संघटन वक्र तथा PLQ क्वथनांक- द्रव संघटन वक्र हैं द्रव का वक्र नीचे की ओर तथा वाष्प का वक्र ऊपर की ओर होता है क्योंकि स्थिर दाब पर क्वथनांक से अधिक ताप पर ही वाष्प प्रावस्था हो सकती है माना कि A और B से बने विलयन का संघटन Y है। इस विलयन को गर्म करने पर इसका वाष्प दाब बढ़ता है और एक ताप Ty पर स्थिर हो जाता है जो कि बाह्य दाब के बराबर है अतः Ty संघटन Y के विलयन का क्वथनांक है | Ty ताप पर वाष्प प्रावस्था का संघटन Z है जिसमें कि अधिक वाष्पशील अवयव B की प्रतिशतता अधिक है यदि इस वाष्प को संघनित कर लिया जाये तो Z संघटन का विलयन प्राप्त हो जायेगा। यह विलयन T1⁄2 ताप पर उबलने लगेगा। और इस ताप पर प्राप्त वाष्प प्रावस्था का संघटन Z’ होगा जिसमें कि B की प्रतिशतता और अधिक हो जाती है। यदि बार-बार इस प्रक्रम को दोहराया जाता है तो अन्त में शुद्ध B (जो कि अधिक वाष्पशील है) की वाष्प को पृथक किया जा सकता है।
इस सिद्धान्त को और अधिक स्पष्ट करने के लिये हम टॉलूईन-बेंजीन विलयन के द्रव वा प्रावस्था आरेख का अध्ययन करेंगे। चित्र 4.18 में आरेख दिखाया गया है।
चित्र के अनुसार टॉलूईन-बेंजीन का 50% मोल प्रतिशतता का विलयन 92.5°C पर उबलता है इस ताप पर वाष्प प्रावस्था में बेंजीन का मोल प्रतिशत 71.5 तथा टॉलूईन का 28.5 है। इस वाष्प को संघनित करने पर इसी मोल प्रतिशतता का विलयन प्राप्त होता है। इस मोल प्रतिशतता के विलयन
को गर्म करने पर यह 86.2°C पर उबलने लगता है। इस ताप पर इसकी वाष्प प्रावस्था में बेंजीन का मोल प्रतिशत 86 तथा टॉलूईन का 14% है। इस प्रकार विभिन्न ताप पर प्राप्त वाष्प प्रावस्था को संघनित कर फिर वाष्प में बदलने पर अधिक वाष्पशील द्रव बेंजीन की प्रतिशतता बढ़ती जाती है और अन्त में बेंजीन पृथक की जा सकती है।
अनादर्श विलयन का ताप वाष्प दाब वक्र (Temperatur-Vapour pressure curve for Non-Ideal Solution)
स्थिर क्वाथी मिश्रण (Azeotropic mixture)
अनादर्श विलयन जो कि राऊल के नियम से विचलन दर्शातें हैं, के अवयवों को प्रभाजी आसवन द्वारा पृथक नहीं किया जा सकता क्योंकि वे एक स्थिर क्वाथी मिश्रण बना लेते हैं।
एक निश्चित संघटन का वह विलयन जो कि एक निश्चित ताप पर उबलता है तथा इस ताप विलयन एवं वा॒ष्प प्रावस्था का संघटन समान रहता है, स्थिर क्वाथी मिश्रण (Azeotropic mixture) कहलाता है। स्थिर क्वांथी मिश्रण दो प्रकार होते हैं
(i) कुछ द्रव युग्म राऊल के नियम से धनात्मक विचलन दर्शाते हैं, वे न्यूनतम ताप स्थिर क्वाथी मिश्रण (minimum boiling azeotrope) बनाते हैं।
(ii) कुछ द्रव युग्म राऊल के नियम से ऋणात्मक विचलन दर्शाते हैं वे अधिकतम ताप स्थिर क्वाथी मिश्रण (Maximum boiling azeotrope) बनाते हैं। यहाँ हम दोनों प्रकार के स्थिर क्वाथी मिश्रणों का विवेचन करेंगे।
न्यूनतम ताप स्थिर क्वाथी मिश्रण (Minimum boiling point Azeotrope)
जैसा कि पूर्व में बताया जा चुका है कि वे द्रव युग्म जो कि राऊल के नियम से धनात्मक विचलन दर्शाते हैं, इस प्रकार के स्थिर क्वाथी मिश्रण बनाते हैं। चित्र 4.19 में इस प्रकार के द्रव युग्म के ताप संघटन वक्र दर्शाये गये हैं।
चित्र में बिन्दु M पर का ताप वह न्यूनतम ताप है जिस पर Y संघटन की वाष्प प्रावस्था है, अतः यह बिन्दु स्थिर क्वाथी मिश्रण का संघटन तथा स्थिर ताप TA प्रदर्शित करता है।
माना कि संघटन Z के एक विलयन को गर्म किया जाता है। यह विलयन T, पर उबलने लगेगा तथा वाष्प प्रावस्था का संघटन Z’ होगा जिसमें कि अधिक वाष्पशील अवयव B की प्रतिशतता अधिक होगी। पूर्व में बताये गये अनुसार इस प्रक्रम को बार-बार दोहराने पर अवशेष में A की प्रतिशतता बढ़ती जायेगी लेकिन इसके साथ Y संघटन का विलयन अवश्य रहेगा क्योंकि इसका क्वथनांक अन्य सभी संघटन के विलयनों से कम है। अतः अवशेष में शुद्ध A प्राप्त नहीं किया जा सकता। इसी प्रकार वाष्प प्रावस्था में B की प्रतिशतता बढ़ती जायेगी परन्तु इसके साथ Y संघटन की वाय अवश्य रहेगी अतः वाष्प प्रावस्था से शुद्ध B प्राप्त नहीं किया जा सकता है।
जल-एथेनॉल तंत्र (Water Ethanol System) जल-एथेनॉल मिश्रण जिसमें 95.6% (भार से) एथेनॉल होती है जो निम्नताप M बिन्दु पर 78.13°C व एक वायुमण्डलीय दाब पर उबलता है। अतः आसवन द्वारा शुद्ध निरपेक्ष एथेनॉल प्राप्त करना बहु कठिन है इस कठिनाई को दूर करने के लिए 95.6% एथेनॉल में बेंजीन मिला देते हैं जो जल के साथ निम्न क्वाथी मिश्रण (low boiling points azotrope) बनाती है और आसवन करने पर शुद्ध एथेनॉल प्राप्त की जा सकती है।
इस प्रकार के द्रव-युग्म उनके संघटन तथा न्यूनतम क्वथनांक निम्न सारणी में दर्शाये गये हैं।
4.27.3 अधिकतम ताप स्थिर क्वाथी मिश्रण (Maximum boiling point Azeotrope ) वे द्रव जो कि राऊल के नियम से ऋणात्मक विचलन दर्शाते हैं, इस प्रकार के स्थिर क्वाथी मिश्रण बनाते हैं। चित्र 4.20 में इस प्रकार के द्रव युग्म के ताप संघटन वक्र दर्शाये गये हैं।
चित्र में बिन्दु M पर का ताप वह अधिकतम ताप है जिस पर Y संघटन का विलयन और Y संघटन की वाष्प प्रावस्था है। अतः यह बिन्दु स्थिर क्वाथी मिश्रण का संघटन तथा स्थिर ताप T को प्रदर्शित करता है।
माना कि संघटन Z के एक विलयन को गर्म किया जाता है यह विलयन T, पर उबलने लगेगा तथा वाष्प प्रावस्था में अवयव A की प्रतिशतता अधिक होगी; अर्थात् संघनित द्रव में A की प्रतिशतता बढ़ती जाती हैं इस प्रक्रम को बार-बार दोहराने पर आसुत में शुद्ध A मिलता है परन्तु अवशेष में Y संघटन का विलयन अवश्य होगा। क्योंकि इसका क्वथनांक अन्य सभी संघटनों के विलयनों से अधिक हैं। अतः शुद्ध B प्राप्त करना संभव नहीं है।
4.27.4 – HC-H20 तंत्र (HCI-H2O System)
शुद्ध जल 100°C पर उबलता है जबकि शुद्ध HCI-85°C पर जबकि इसका स्थिर क्वाथी मिश्रण जिसमें 20.24%HCl है एक वायुमण्डलीय दाब पर 108.5°C पर उबलता है।
इस प्रकार के द्रव युग्म उनके संघटक तथा अधिकतम क्वथनांक निम्न सारणी में दर्शाये गये हैं।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics