उदासीनीकरण ऊष्मा क्या है परिभाषित कीजिए heat of neutralization in hindi definition Experiment
पढ़िए उदासीनीकरण ऊष्मा क्या है परिभाषित कीजिए heat of neutralization in hindi definition Experiment ?
उदासीनीकरण ऐन्थेल्पी (उदासीनीकरण ऊष्मा) का प्रायोगिक निर्धारण (Experimental Determination of Enthalpy of Neutralisation (Heat of Neutralisation)
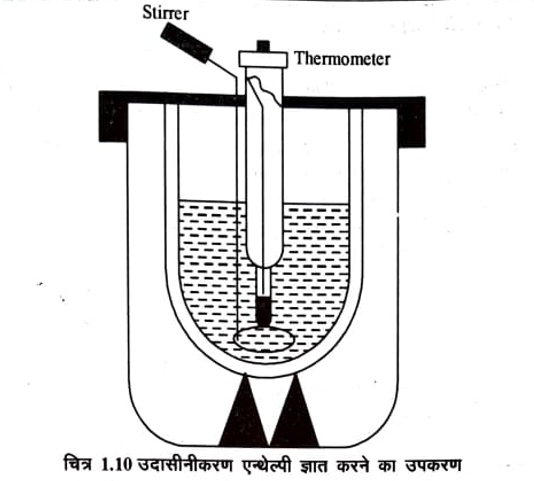
प्रयोग द्वारा उदासीनीकरण ऐन्थेल्पी का मान ज्ञात करने के लिए डेबार फ्लास्क (Dewar Flask) को कैलोरीमीटर के रूप में काम में लिया जाता है, जिसमें एक विलोडक तथा एक बेकमॉन थर्मामीटर लगा होता है। सामान्य प्रेक्षणों के लिये डेबार फ्लास्क के स्थान पर थर्मस फ्लाक्स का उपयोग किया जा सकता है। ऊष्मा का क्षय रोकने के लिए फ्लाक्स को लकड़ी के डिब्बे में नमदा भर कर रखते हैं। चित्र 1.10 में इस प्रकार के उपकरण को दर्शाया गया है।
उदासीनीकरण ऊष्मा का निर्धारण दो पदों में किया जाता है।
(i) प्रयुक्त फ्लास्क, थर्मामीटर, विलोडक आदि का जल तुल्यांक अथवा कैलोरीमीटर स्थिरांक ज्ञात करना- फ्लास्क में माना कि m1ग्राम जल है जिसका ताप T1 है। इस फ्लास्क में अब m2 ग्राम गर्म जल जिसका ताप T2 है डाला जाता है। मिश्रण को विलोडित करके अन्तिम ताप नोट कर लेते है। माना कि अन्तिम ताप T3 है। माना कि फ्लास्क एवं अर्न्तनिहित वस्तुओं का जल तुल्यांक W है। ठंडे जल एवं फ्लास्क आदि द्वारा ग्रहण की गई ऊष्मा
= mj (T3 – T1) + W (T3 – T1 )
(ii) उदासीनीकरण ऐन्थेल्पी ज्ञात करना m2 (T2 – T3) – my(T3-T) W (T3-T1) (T2-T3) W = m2 Tu- (T3-T1) (Determination of Neutralization entlahpy or Heat of Neutralization)- …..(107) समान सांद्रता के अम्ल तथा क्षार के विलयन बना लिये जाते हैं। अम्ल एवं क्षार के विलयनों के समान आयतन दो अलग-अलग बीकरों में लिये जाते हैं। माना कि HCl तथा NaOH की उदासीनीकरण ऊष्मा का निर्धारण करना है। इनके मोलर विलयन बना लेते हैं। M-HCI विलयन के 200 मिलि. कैलोरीमीटर में तथा M-NaOH विलयन के 200 मिली. एक अन्य बीकर में लिये जाते हैं। माना कि अम्ल एवं क्षार के प्रारम्भिक ताप क्रमशः T तथा T हैं। इसके बाद NaOH के संपूर्ण विलयन को तेजी से कैलोमीटर में रखें HCI विलयन में डाल दिया जाता है। मिश्रण को लगातार विलोडित करते हुये, प्रत्येक 30 सैकेण्ड के बाद ताप नोट करते जाते हैं, जब ताप स्थिर हो जाता है तो अन्तिम ताप नोट कर लेते हैं माना कि अन्तिम तापT है । उदासीनीकरण ऊष्मा की गणना निम्न प्रकार की जाती है। मिश्रण का प्रारम्भिक ताप _T4 + Ts = कैलोरीमीटर तथा अर्न्तनिहित वस्तुओं द्वारा ग्रहण की गई ऊष्मा
चूंकि यह ऊष्मा “Q” 200 मिलि. M-HC1 तथा 200 मिलि. M-NaOH अर्थात् = 1/5 ग्रा. मोल HCl तथा 1/5 ग्राम मोल NaOH के उदासीनीकरण से प्राप्त हुई है। अतः 1 ग्रा. मोल HCI तथा 1 ग्रा. मोल NaOH के उदासीकरण से प्राप्त ऊष्मा की मात्रा 5Q होगी। परिभाषा के अनुसार यही उदासीनीकरण एन्थेल्पी (ऊष्मा) का मान होता है-
(5) विलयन ऐन्थेल्पी या विलयन ऊष्मा (Enthaply of Solution or Heat of Solution) जब किसी पदार्थ का विलयन बनाया जाता है तो इस प्रक्रम में सामान्यतया या तो ऊष्मा अवशोषित होती है या ऊष्मा मुक्त होती है ऊष्मा परिवर्तन की मात्रा, पदार्थ एवं विलायक दोनों की मात्रा पर निर्भर करती है। पदार्थ सामान्यतया । मोल लिया जाता है। विलायक की भिन्न-भिन्न मात्राओं के आधार पर दो प्रकार की विलायक ऊष्मा परिभाषित की जाती है।
(i) समाकलन विलयन ऐन्थेल्पी ( Integral Enthalpy of Solution)- “एक मोल पदार्थ को विलायक की अधिक किन्तु निश्चित मात्रा में घोलने पर पूर्ण ऊष्मा (Enthalpy) में हुआ परिवर्तन (AH) पदार्थ की समाकलन विलयन ऊष्मा (एन्थैल्पी) कहलाती है।
कुछ पदार्थों की समाकलन ऊष्मा के मान सारणी 1.4 में दिये गये हैं। सारणी 1.4 : कुछ पदार्थों की समाकलन विलयन ऊष्मा के मान (किलो जूल प्रति मोल) (4.184 कि. जूल = 1 कि. कैलोरी)
यदि पदार्थ के विलयन का तनुकरण (dilution) किया जाता है तो समाकलन विलयन ऐन्थेल्पी के मान में वृद्धि होती हैं सारणी 1.5 में HCI गैस की 25° से. ताप पर कुछ समाकलन विलयन ऊष्मा दी हुई है। इन मानों से भी उक्त तथ्य की पुष्टि होती है।
सारणी 1.5 HCI गैस की समाकलन विलयन ऊष्मा के 25° से. पर मान (किलो जूल प्रति मोल) (4.184 कि. जूल = 1 कि. कैलोरी)
उपरोक्त सारणी से स्पष्ट है कि तनुता के साथ H के मान में वृद्धि होती है और अन्ततः एक सीमान्त (limiting value) प्राप्त होती है, इस विलयन को अनन्तः तनु विलयन (Infinitely dilute solution) कहा जाता है। H का यह सीमान्त मान पदार्थ की विलयन ऊष्मा कहलाती है इसे AH से प्रदर्शित करते हैं।
(ii) विलयन ऊष्मा (Heat of solution)- उपरोक्त निष्कर्ष से विलयन ऊष्मा की परिभाषा निम्न प्रकार से दी जा सकती है। “पूर्ण ऊष्मा में वह परिवर्तन जो कि 1 मोल पदार्थ को जल के आधिक्य में घोलने पर उत्पन्न हो और अधिक तनुकरण करने पर कोई ऊष्मा विनिमय न हो।” विलयन ऊष्मा को निम्न ऊष्मा रसायन समीकरण द्वारा व्यक्त कर सकते हैं।
(iii) तनुकरण की ऊष्मा (Heat of Dilution or Enthalpy of dilution)- “पूर्ण ऊष्मा में वह परिवर्तन जो कि विलयन की एक सान्द्रता से दूसरी सान्द्रता तक तनु करने में होता है, तनुकरण की ऊष्मा कहलाती है।” इसका मान पदार्थ की दो समाकलन विलयन ऊष्माओं के अंतर के बराबर होता है। सारणी 1.5 के प्रथम दो मानों के आधार पर HCI की समाकलन विलयन ऊष्मा निम्न समीकरणों द्वारा व्यक्त की जाती है।
समीकरण (111) में से समीकरण (110) को घटाने पर
अतः 1 मोल HCl के 10 मोल में घुले विलयन को 15 मोल जल द्वारा तनु करने पर – 3.02 कि. जूल ऊष्मा मुक्त होती है। अतः यह तनुकरण ऊष्मा कहलाती है।
(6) जलयोजन ऐन्येल्पी अथवा जलयोजन ऊष्मा (Enthalpy of Hydration)- निर्जल लवणों में यदि जल डाला जाता हैं तो जलयोजित लवण (Hydrated salts) प्राप्त होता है। यह प्रक्रम भी ऊष्मा क्षेपी होता हैं अर्थात् ऊष्मा मुक्त होती है।
“एक मोल निर्जल लवण में जल की निश्चित मात्रा डालकर निश्चित जलयोजित लवण बनने में होने वाला पूर्ण ऊष्मा परिवर्तन लवण की जलयोजित ऊष्मा या जलयोजन ऐन्थेल्पी कहलाती है।”
जलयोजन ऊष्मा का प्रत्यक्ष मापन नहीं किया जा सकता परन्तु विलयन ऊष्माओं का उपयोग करके अप्रत्यक्ष रूप से जलयोजन ऊष्मा का परिकलन निम्न विधि द्वारा किया जा सकता है। मान लीजिये कि कॉपर सल्फेट की जलयोजन ऊष्मा ज्ञात करनी है । अर्थात्
hyH का मान ज्ञात करने के लिये हमें CuSO4 (s) की विलयन ऊष्मा की आवश्यकता होगी-
माना कि जलयोजन ऊष्मा का मान x कि. जूल है अतः
समीकरण (ii) व समीकरण (iii) को जोड़ने पर
समीकरण (iv) तथा समीकरण (i) की तुलना करने पर
X + 11.72 = – 66.48
X = – 66.48 – 11.72
=- 78.2 कि. जूल
अतः CuSO4का CuSO4, 5H2O में परिवर्तित होने में 78.2 कि. जूल ऊष्मा मुक्त होगी।
(7) प्रावस्था संक्रमण ऐन्थेल्पी (ऊष्मा ) (Enthalpy of Phase Transition)-
जब पदार्थ की एक प्रावस्था (phase) से दूसरी प्रावस्था में संक्रमण होता है। तब भी पूर्ण ऊष्मा में परिवर्तन होते हैं।
“एक मोल पदार्थ (परमाणु/ अणु) की एक प्रावस्था से दूसरी प्रावस्था में परिवर्तन के परिणाम स्वरूप हुआ पूर्ण ऊष्मा परिवर्तन (H) प्रावस्था संक्रमण ऊष्मा ( H) कहलाती है। ”
यदि प्रावस्था परिवर्तन एक अपर रूप से दूसरे अपर रूप में होते हो तो पूर्ण ऊष्मा परिवर्तन संक्रमण ऊष्मा (Heat of transition) कहलाती है। उदाहरण के लिये
C (हीरा) → C (ग्रेफाइट); H = -1.89 कि. जूल
एक मोल कार्बन (हीरा) के कार्बन (ग्रेफाइट) में परिवर्तन में 1.89 कि. जूल ऊष्मा या एन्थेल्पी मुक्त होती है। अतः इससे यह निष्कर्ष निकलता है कि हीरे की अपेक्षा ग्रेफाइट अधिक स्थायी है । इस प्रकार एक मोल विषमलम्बाक्ष गंधक को एक मोल एकनताक्ष गंधक में परिवर्तन करने में 0.71 कि. कैलोरी ऊष्मा अवशोषित होती है ।
S (विषमलम्बाक्ष) = S (एकनताक्ष); H = + 0.71 कि. कैलोरी या 2.96 कि.
(8) गलन की ऊष्मा (Heat of fusion)-
एक मोल पदार्थ के ठोस प्रावस्था से द्रव प्रावस्था में परिवर्तन होने पर जो पूर्ण ऊष्मा में परिवर्तन होता है उसे गलन की ऊष्मा या ऐन्थेल्पी (AfusH) कहते हैं। उदाहरणार्थ एक मोल जल (ठोस) अर्थात् बर्फ, जल द्रव में बदलने पर 6.0 कि. जूल ऊष्मा अवशोषित करता है अतः बर्फ की गलन ऊष्मा 6.0 कि. जूल है ।
H2O(s) → H2O(/); fus H = 60.0 कि. जूल
(9) वाष्पन की ऊष्मा (Heat of Vaporisation)-
दिय गये ताप तथा दाब पर एक मोल द्रव के गैस प्रावस्था में परिवर्तित होने पर पूर्ण ऊष्मा या ऐन्थल्पी का परिवर्तन वाष्पन की ऊष्मा कहलाती है।
(10) ऊर्ध्वपातन की ऊष्मा (Heat of Sublimation)- एक मोल पदार्थ के ठोस (Volatile Solid) पदार्थ के सीधे वाष्प प्रावस्था में परिवर्तन होने पर पूर्ण ऊष्मा या ऐन्यैल्पी में परिवर्तन होता हैं उसे ऊर्ध्वपातन की ऊष्मा (AsubH) कहते हैं। उर्ध्वपातन की ऊष्मा, वाष्पन की ऊष्मा तथा गलन की ऊष्मा का योग होती है
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics