Heat of Combustion in hindi Experimental Determination of दहन ऊष्मा का प्रायोगिक निर्धारण
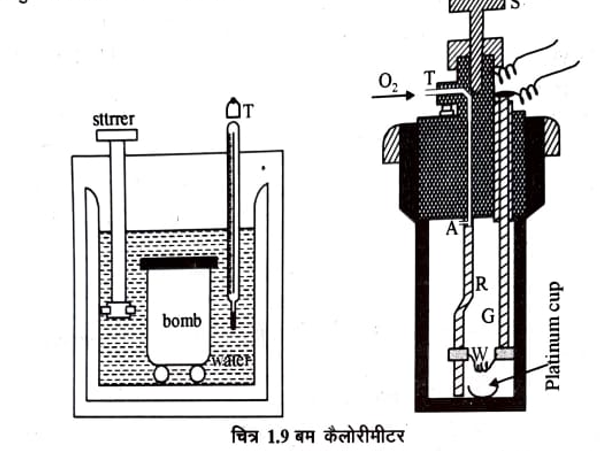
दहन ऊष्मा का प्रायोगिक निर्धारण क्या है प्रयोग से समझाइये Heat of Combustion in hindi Experimental Determination of experiment diagram ?
दहन ऊष्मा का प्रायोगिक निर्धारण (Experimental Determination of Heat of Combustion)- दहन ऊष्मा के प्रायोगिक निर्धारण के लिऐ बम कैलोरीमीटर (Bomb Calorimeter) का उपयोग किया जाता है। चित्र 1.9 में बम कैलोरीमीटर दर्शाया गया हैं इसमें एक आन्तरिक कक्ष “B” होता है जो कि मजबूत स्टनलैस स्टील का बना होता है। कक्ष को बन्द करने के लिये एक वायुरोधी पेच “S” लगा होता है जो कि O2 भरने के लिये लगी पार्श्वनलिका “A” को भी बन्द करता है। एक प्लेटिनम का छोटा कप C है जो कि एक छड़ R द्वारा लटका हुआ है। कप के ऊपर एक प्लेटीनम का तार लगा है जो कि छड़ G द्वारा जुड़ा हैं छड़ R तथा G को विद्युत परिपथ से जोड़ा जा सकता है। जिस पदार्थ की दहन ऊष्मा का निर्धारण करना होता है, उसकी ज्ञात मात्रा कप “C” में रख देते हैं। अब पार्श्वनलिका A द्वारा बम में 20 से 25 वायुमण्डल दाब पर ऑक्सीजन गैस भर दी जाती है पेच S को बन्द कर दिया जाता है। इस पूरे बम को एक अन्य कैलोरीमीटर D में रख देते हैं, जिसमें जल की ज्ञात मात्रा भरी है। इस कैलोरीमीटर में एक विलोडक तथा एक थर्मामीटर T लगा हुआ है जो कि एक डिग्री के सौवें भाग को माप सकता है। कैलोरीमीटर को पूर्णतया ऊष्मारोधी बना दिया जाता है ताकि दहन रुद्धोष्म स्थिति में हो सके। इसके प्रारम्भिक ताप को नोट कर लेते हैं। इसके पश्चात् विद्युत धारा प्रवाहित करके प्लेटीनम के तार को गर्म किया जाता है।
इस प्रकार कप में रखा पदार्थ जलने लगता है। ऑक्सीजन की अधिकता के कारण पदार्थ का पूर्ण ऑक्सीकरण हो जाता है। मुक्त हुई ऊष्मा से बम कैलोरीमीटर व जल का ताप बढ़ता है। स्थिर होने पर अन्तिम ताप नोट कर लेते हैं। किसी पदार्थ जिसकी दहन ऊष्मा ज्ञात हो सामान्यतया शुद्ध बेंजोइक अम्ल का दहन करके बम कैलोरीमीटर की ऊष्मा धारिता ज्ञात की जाती है। इन सबसे स्थिर आयतन पर दहन ऊष्मा की गणना निम्न प्रकार की जाती है।
माना कि बम कैलोरीमीटर की ऊष्मा धारिता C, लिये गये पदार्थ का द्रव्यमान w तथा अणुभार M है। यदि T तथा T2 कैलोरीमीटर व जल के प्रारम्भिक व अन्तिम ताप हो तो
स्थिर आयतन पर दहन ऊष्मा है। स्थिर दाब पर दहन ऊष्मा (AH) का मान निम्नलिखित समीकरण द्वारा प्राप्त किया जा सकता है।
H = E + n(g) RT
बहुत उत्तम परिणाम प्राप्त करने के लिये प्लेटीनम के तार द्वारा मुक्त हुई ऊष्मा, पारिपाश्विक से प्राप्त ऊष्मा आदि के लिये उचित संशोधन किये जाते हैं।
दहन ऐन्येल्पी (ऊष्मा) के अनुप्रयोग (Applications of Heat of Combustion or Combustion Enthalpy)
(i) संभवन ऊष्मा (ऐन्थेल्पी) की गणना (Calculation Heat of Combustion)-
कार्बनिक यौगिकों की दहन ऊष्माओं का परिकलन अपेक्षाकृत सरलता से ज्ञात किया जा सकता । अतः इसका उपयोग इनकी संभवन ऊष्माओं की गणना करने के लिये किया जाता है। इसका उपयोग संक्रमण ऊष्मा ज्ञात करने में भी करते हैं।
उदाहरण- मेथेन की दहन ऊष्मा का उपयोग उसकी संभवन ऊष्मा ज्ञात करने के लिये किया जा सकता है यदि कार्बनडाइऑक्साइड तथा जल की संभवन ऊष्माऐं ज्ञात हो।
(ii) ईधन की ऊष्मा उत्पादता (Calorific value of fuel)-
किसी पदार्थ की एक ग्राम मात्रा के पूर्ण दहन से ऊष्मा की जो मात्रा उत्पन्न होती है उसे पदार्थ की ऊष्मा उत्पादकता या कैलोरी मान कहते हैं। इसका तात्पर्य यह है कि कम ईंधन काम में लेने पर भी अधिक ऊष्मा का उत्पादन। यह ईंधन के लिए अत्यंत महत्वपूर्ण मान है। इस प्रकार ऊष्मा उत्पादकता ज्ञात होने से उद्योगों के लिए सस्ता व उचित ईंधन खरीदने में सहायता मिलती है। कोयला, पेट्रोल, केरोसीन आदि ईंधन के श्रेणीकरण (Gradation) ऊष्मा उत्पादकता के आधार पर करते हैं।
(iii) खाद्य पदार्थों के कैलोरीमान (Calorific value of food stuffs)-
अच्छे स्वास्थ्य के लिए संतुलित भोजन आवश्यक है। जो खाद्य पदार्थ हम खाते हैं वे हमारे शरीर में ऑक्सीकृत होकर ऊर्जा प्रदान करते हैं। अतः विभिन्न खाद्य पदार्थों की दहन ऊष्मा ज्ञात होने से हमें उनकी हमारे शरीर को ऊर्जा प्रदान करने की क्षमता का ज्ञान होता है। अतः विभिन्न खाद्य पदार्थों के कैलोरीमान ज्ञात होने पर संतुलित भोजन की न्यूनतम आवश्यकता पूरी करने के लिए दैनिक भोजन में उनकों सम्मिलित करते हैं।
(iv) कार्बनिक यौगिकों की संरचना निर्धारण में(Determination of Structure of Organic Compounds)-
किसी भी सजातीय श्रेणी के सजातों की दहन ऊष्माओं में एक निश्चित अंतर होता है। अर्थात् दहन ऊष्मा एक निश्चित क्रम से घटती है। मेथेन की दहन ऊष्मा – 222 कि. कैलोरी है तथा इसके बाद के. पेराफीन हाइड्रोकार्बन श्रेणी में दो क्रमागत सदस्यों (जिनमें CH2 समूह का अन्तर होता है) की दहन ऊष्माओं के मान 15.8 कि. कैलोरी का अंतर होता है तथा यह 15.8 से घटता चला जाता है।
अतः इस सजातीय श्रेणी के किसी सदस्य की दहन ऊष्मा AH = 222 n (15.8) कि. कैलोरी होगी।
यहा n = – CH2 समूहों की संख्या है। जिन्हें CH4 में जोड़ने से हाइड्रोकार्बन का अणु सूत्र ज्ञात होता न है तथा n का मान भी ज्ञात किया जा सकता है अगर cH दहन ऊष्मा ज्ञात हो। इसी प्रकार अन्य कार्बनिक सदस्यों की सहायता से हम भिन्न-भिन्न परमाणुओं, समूहों तथा बन्धों की दहन ऊष्माओं का ज्ञात कर सकते हैं। केकुले ने दहन ऊष्मा के आधार पर बेंजीन में तीन एकान्तर एकल बन्ध और द्विबन्ध की उपस्थिति का पता लगाया ।
(3) उदासीनीकरण ऐन्थेल्पी या उदासीनीकरण ऊष्मा (Enthalpy of Neutralisation or Heat of Neutralisation)-
अम्ल एवं क्षार की पारस्परिक अभिक्रिया को उदासीनीकरण अभिक्रिया कहते हैं। “एक ग्राम तुल्यांक अम्ल तथा एक ग्राम तुल्यांक क्षार के तनु विलयनों की परस्पर पूर्ण उदासीनीकरण अभिक्रिया के फलस्वरूप पूर्ण ऊष्मा में हुआ परिवर्तन (neuH) उदासीनीकरण ऐन्थेल्पी या उदासीनीकरण ऊष्मा (Enthalpy of neutralisation or Heat of neutralisation) कहलाती है।
उदाहरणार्थ- HCI तथा NaOH की उदासीनीकरण ऊष्मा को निम्न समीकरण द्वारा प्रदर्शित किया जा सकता है।
HCl(aq) + NaOH (aq) = NaCl (aq) + H2O (l; H° 298 = -13.7 कि. कैलोरी
जब 36.5 ग्राम (एक ग्राम तुल्यांक ) HCl 40 ग्राम NaOH (एक ग्राम तुल्यांक) को उदासीन करता है तो 13.7 कि. कैलोरी (57.0kJ) ऊष्मा उत्पन्न होती है। जो उदासीनीकरण ऊष्मा है। हैस (Hess) ने प्रयोग द्वारा यह ज्ञात किया कि प्रबल क्षारों की उदासीनीकरण ऊष्मा का मान लगभग स्थिर रहता है। यह मान अम्ल या क्षार की प्रवृति पर निर्भर नहीं करता ।
प्रबल अम्ल तथा प्रबल क्षार की उदासीनीकरण ऊष्मा की स्थिरता को आयनन सिद्धान्त द्वारा समझाया जाता है। प्रबल अम्ल तथा प्रबल क्षार तथा उनके उत्पाद प्रबल विद्युत् अपघट्य होते हैं जिन्हें लगभग पूर्ण आयनिक माना जाता है। अतः उपरोक्त ऊष्मा रासायनिक समीकरण को निम्न प्रकार से लिखा जा सकता है-
अतः उदासीनीकरण ऊष्मा को 1 ग्राम मोल H+ (aq) तथा 1 ग्रा. मोल OH- (aq) द्वारा बने H2O(l)की संभवन ऊष्मा माना जा सकता है। चूंकि प्रत्येक प्रबल अम्ल तथा प्रबल क्षार के 1 ग्रा. तुल्यांक से प्राप्त H★ व OH- के मोलों की मात्रा समान होगी। अतः उनके संयोग से बने जल तथा प्राप्त ऊष्मा की मात्रा भी समान होगी जो कि 13.7 कि. कैलोरी या 57.0 कि. जूल है।
उदासीनीकरण अभिक्रिया में यदि अम्ल या क्षार दुर्बल होते हैं तो उदासीनीकरण ऊष्मा का मान 13.7 कि. कैलोरी से कम प्राप्त होता है।
उदाहरणार्थ-
इन अभिक्रियाओं में उदासीनीकरण अभिक्रिया के साथ ही दुर्बल अम्ल या दुर्बल क्षार आयनन भी होता है। कुछ ऊष्मा आयनन की प्रक्रिया में अवशोषित होती है, परिणाम स्वरूप मुक्त हुई ऊष्मा का मान 13.7 कि. कैलोरी से कम होता है ।
यदि अम्ल और क्षार दोनों ही दुर्बल हों तो मुक्त हुई ऊष्मा का मान ओर भी कम प्राप्त होगा क्योंकि दुर्बल अम्ल तथा दुर्बल क्षार दोनों के आयनन में ऊष्मा अवशोषित होगी। उदाहरणार्थ-
(4) आयनन ऐन्थेल्पी या आयनन ऊष्मा (Enthalpy of Ionisation or Heat of Ionsiation)
उपरोक्त प्रेक्षणों के आधार पर दुर्बल अम्ल या दुर्बल क्षार की आयनन ऊष्मा (Heat of Ionisation) की गणना की जा सकती है। “एक मोल दुर्बल अम्ल या दुर्बल क्षार के पूर्ण आयनन में अवशोषि ऊष्मा को उस अम्ल या क्षार की आयनन ऊष्मा आयनन ऐन्थेल्पी कहते हैं।” आयनन ऊष्मा की गणना निम्नलिखित उदाहरण द्वारा समझाई जा सकती है।
उदाहरण 23. निम्नलिखित आंकड़ों से NH4OH की 25° से. पर आयनन ऐन्थेल्पी की गणना कीजिये ।
उपरोक्त समीकरण चूंकि NH4OH के आयनन ऐन्थेल्पी को दर्शाती है। अतः 25° से. पर NH4OH के आयनन की ऊष्मा + 1.43 कि. कैलोरी होगी ।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics
