सक्रियता एवं सक्रियता गुणांक क्या है , प्रतिलोम परासरण के उपयोग , परासरण दाब एक अणुसंख्यक गुण
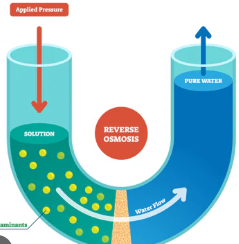
व्युत्क्रम परासरण /प्रतिलोम परासरण (reverse osmosis) : यदि विलयन पर परासरण दाब से अधिक दाब लगाया जाए तो परासरण की प्रक्रिया विपरीत दिशा में होने लगती हैं। अर्थात विलायक के कण अर्द्धपारगम्य झिल्ली द्वारा विलयन से शुद्ध विलायक की और गमन करने लगते है। यही परिघटना व्युत्क्रम परासरण कहलाती हैं।
प्रतिलोम परासरण के उपयोग
असामान्य मोलर द्रव्यमान या असामान्य अणुभार
+ B–
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics